上部消化管内視鏡検査
上部消化管内視鏡検査とは、咽頭、食道、胃、十二指腸を対象として、内視鏡を体内に挿入し直接観察して疾患を診断するとともに病態を把握する検査です。通常内視鏡検査と色素を撒くことにより病変を分かりやすくする色素内視鏡検査があります。
色素内視鏡検査には色素液の陥凹面へのたまり現象を応用して凹凸を強調させるコントラスト法(インジゴカルミンなど)や色素と粘膜の分泌物や細胞成分との特異反応を利用する反応法(ヨード、酢酸、クリスタルバイオレットなど)があります。食道疾患ではヨードが、胃疾患ではインジゴカルミンや酢酸がよく使われます。
また、光の波長特性を利用して拡大観察を行うことにより診断を行うこともあります。
病変の一部を採取して顕微鏡で詳しく診断する生検組織検査も同時に行います。
狭帯域光拡大内視鏡観察を用いた早期胃癌の診断
通常光観察では認識が困難な小さな早期胃癌でも狭帯域光拡大内視鏡観察を用いることで胃癌と診断することが容易に可能となりました。
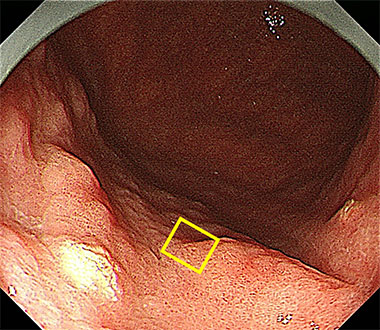
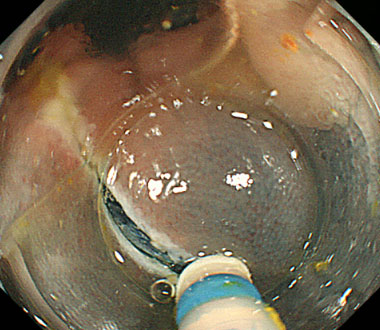
胃体部大弯に存在する微小な早期胃癌。
通常光観察では病変の存在すら分かりません。
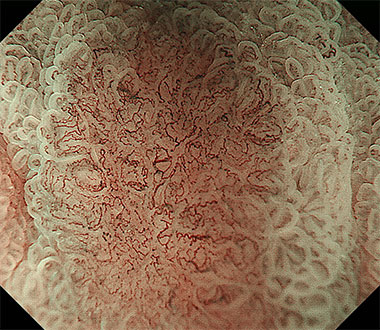
狭帯域光拡大内視鏡観察を用いることで5mmの早期胃癌の診断が可能となりました。
超音波内視鏡検査
専用のプローベを用いて胃癌の深さや粘膜の下に存在する腫瘍の診断に用います。
早期胃癌に対する超音波内視鏡検査画像病理像との対比
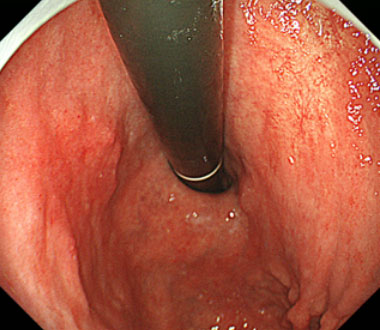
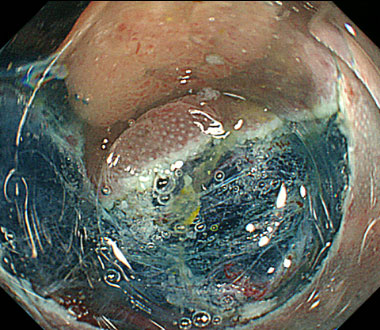
0-Ⅱc型早期胃癌
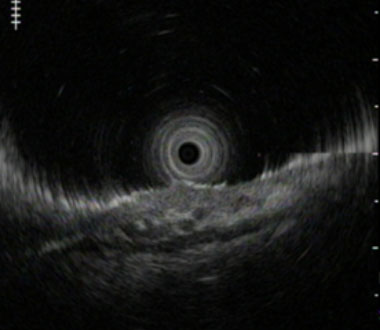
超音波内視鏡では癌が粘膜下層へ浸潤しており粘膜下層には血管も豊富に存在します。

内視鏡的粘膜下層剥離術により病変は切除され、病理検査でも粘膜下層への腫瘍の浸潤を認めました。
胃粘膜下腫瘍に対する超音波内視鏡検査画像
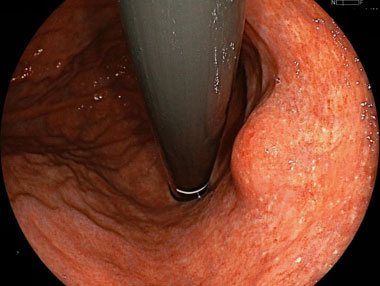
胃体部小弯に粘膜下腫瘍を認めます。通常内視鏡では正常粘膜に覆われており正確な診断は困難です。
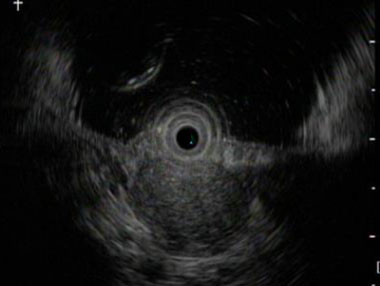
超音波内視鏡を用いると粘膜下の腫瘍を描出することが可能となります。
検査実績
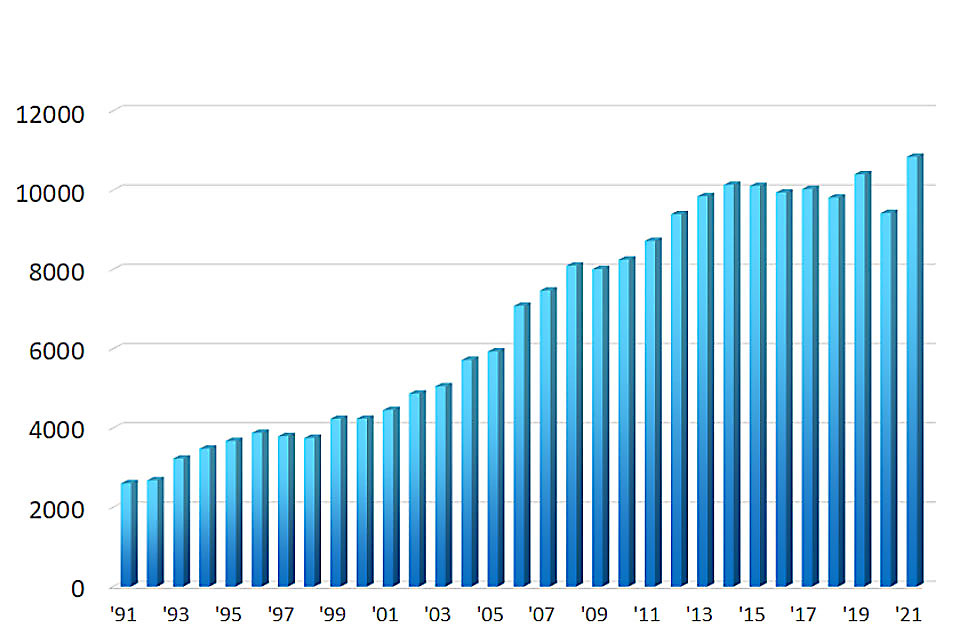
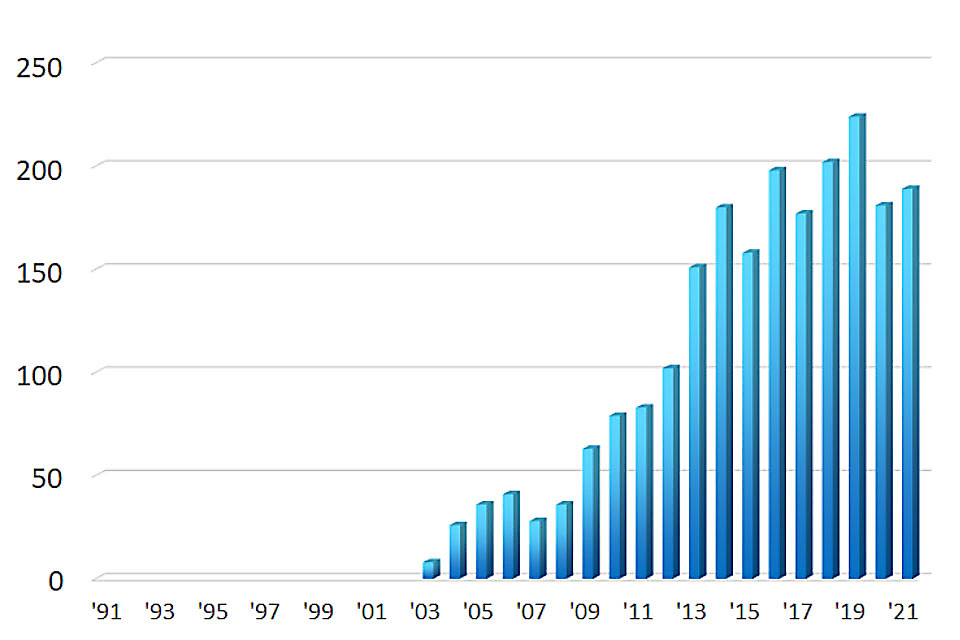
上部消化管内視鏡検査数
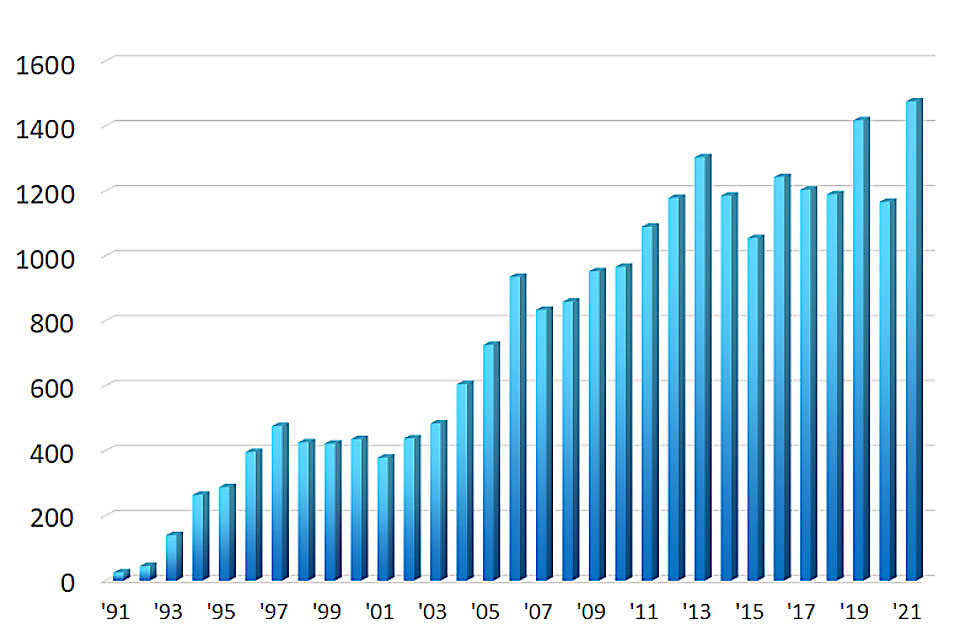
超音波内視鏡検査数 (食道、胃、大腸)
小腸内視鏡検査
小腸は十二指腸、空腸、回腸で構成される全長約6mにも及ぶ長大な臓器です。空腸、回腸は通常の上部消化管内視鏡、大腸内視鏡で到達が困難であり、長らく「暗黒の臓器」と呼称されてきました。しかし、近年ではカプセル内視鏡とバルーン内視鏡の普及に伴い、小腸の観察が容易となってきました。
当院ではカプセル内視鏡、シングルバルーン内視鏡およびダブルバルーン内視鏡を備えており、小腸疾患診療にも尽力しています。それぞれ利点、欠点が存在するため、患者さんの状態を勘案しながらどの検査を行うかを決定します。
ダブルバルーン内視鏡検査
ダブルバルーン内視鏡はスコープ先端にバルーンが装着できる内視鏡本体と、同じく先端にバルーンの付いたオーバーチューブから構成されています。バルーンを交互に拡張させることにより腸管を固定し、小腸挿入時の問題である過伸長を防ぎ、小腸を短縮しながらの挿入が可能となります。ダブルバルーン内視鏡は小腸のみならず、通常の大腸内視鏡で盲腸まで到達困難な症例に対する大腸内視鏡や、術後再建腸管に対するERCPにも活用されます。

内視鏡本体
内視鏡光源とのセッティング
X線透視を使用可能な内視鏡室。管球を散乱線防護クロスで覆うことで検査者の被曝も低減させています。

当科での実際のダブルバルーン内視鏡施行現場。スコープを実際に操作する術者とオーバーチューブを支える介助者2名で検査を行います。
ダブルバルーン内視鏡で撮影された内視鏡画像
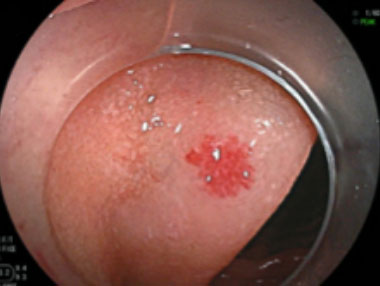
angioectasia Type 1b
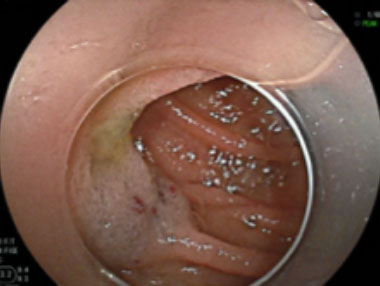
血管腫
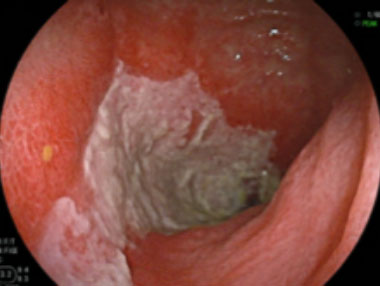
虚血性小腸炎
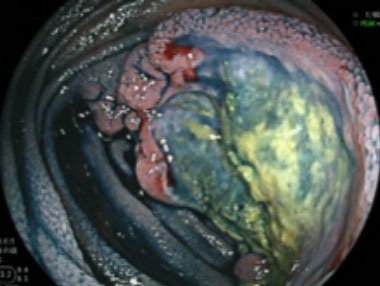
悪性リンパ腫 (DLBCL)
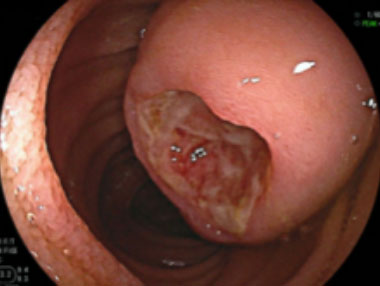
GIST
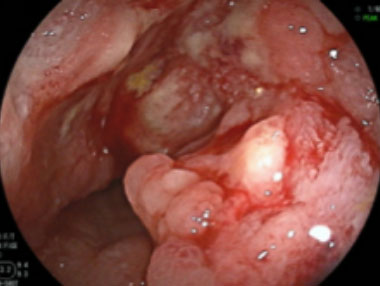
原発性小腸癌
小腸カプセル内視鏡検査
カプセル内視鏡検査は、カプセル型の内視鏡を嚥下するだけで小腸を観察することが可能な内視鏡です。現在、小腸疾患の検査における第一選択とされ、世界中で広く使用されています。体外に装着したレコーダーが、嚥下したカプセル内視鏡の撮影した画像データを受診します。データの送受信に伴い電磁波が発生するため、ペースメーカーや植え込み型除細動器が留置された症例には施行できません。検査時間はおよそ8時間で、検査の間は日常動作が可能です。
当科でカプセル内視鏡の読影を行なっている部屋です。

実際の読影風景です。最大で同時に3つの検査まで読影が可能です。
小腸カプセル内視鏡で使用する機材

カプセル
レコーダー

センサアレイ

ワークステーション
小腸カプセル内視鏡で撮影された内視鏡画像
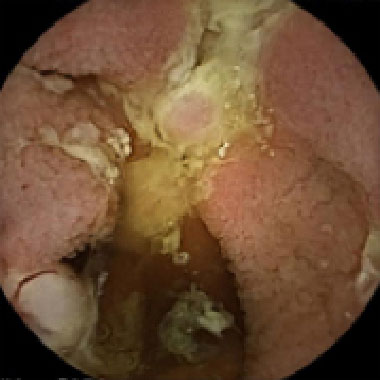
クローン病
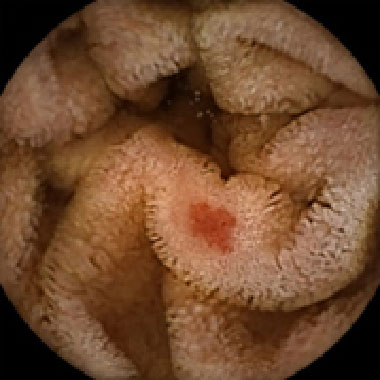
angioectasia Type 1b
Peutz-Jeghers症候群
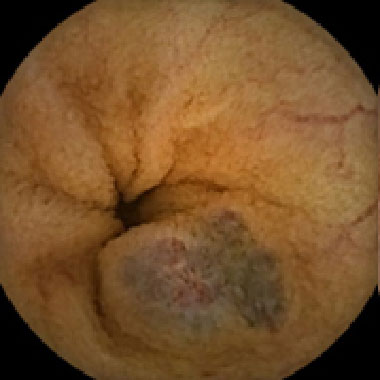
血管腫
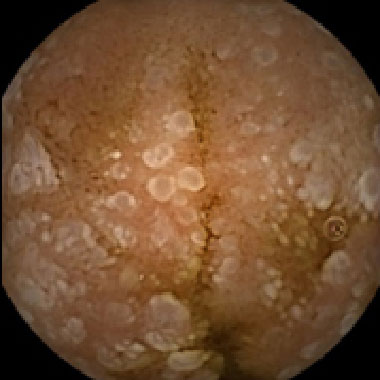
悪性リンパ腫
(濾胞性リンパ腫)
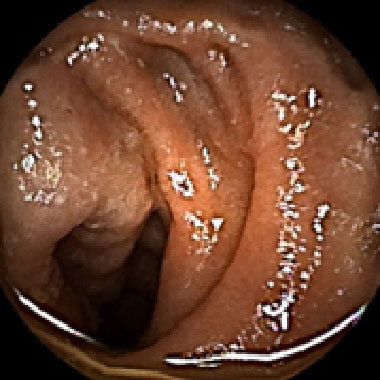
GIST
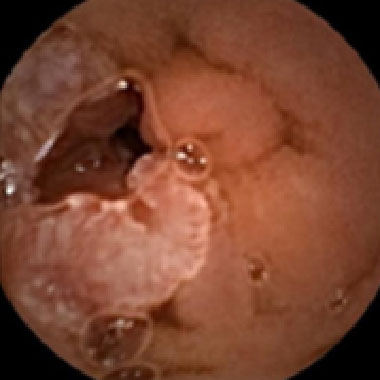
原発性小腸癌 (進行癌)
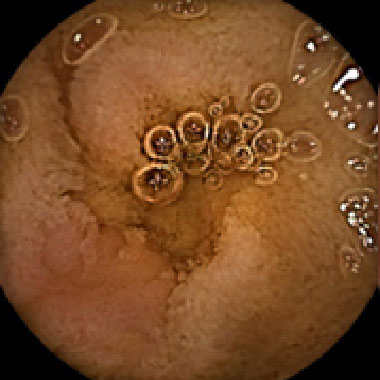
原発性小腸癌 (早期癌)
検査実績
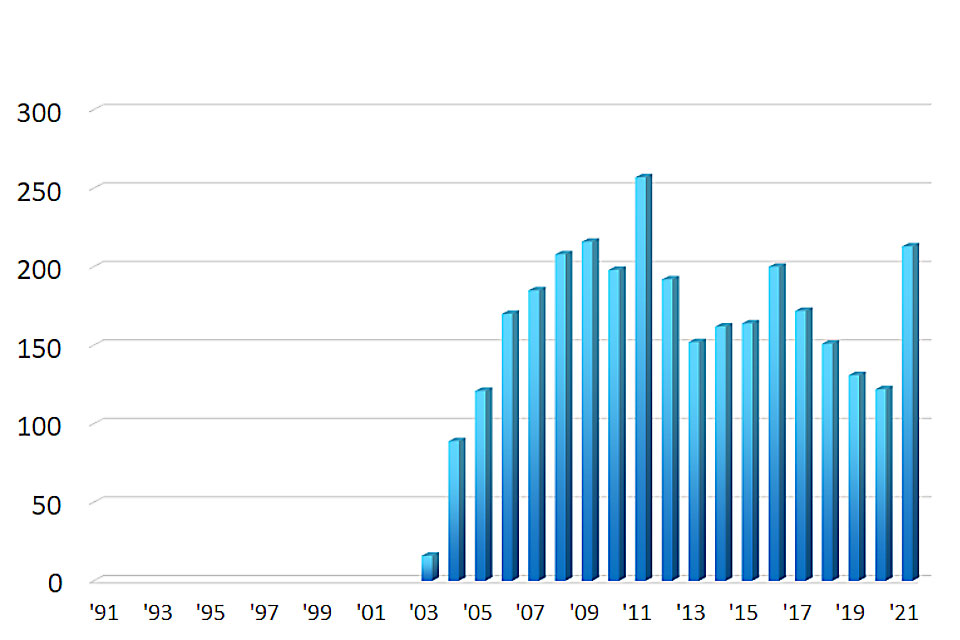
ダブルバルーン内視鏡検査数
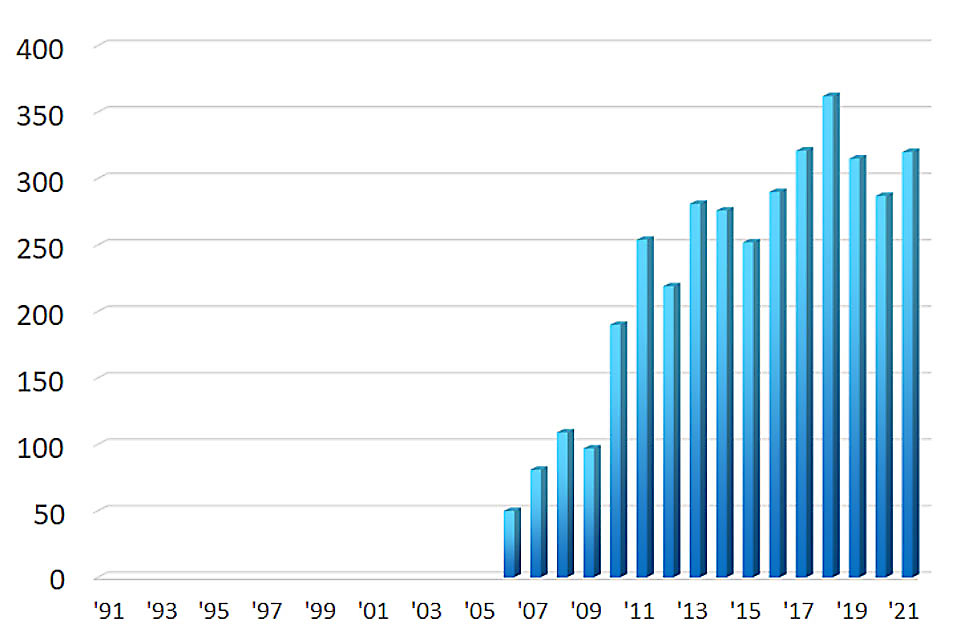
小腸カプセル内視鏡検査数
大腸内視鏡検査
大腸内視鏡検査とは、結腸、直腸を対象として(時に回腸末端部も)、内視鏡を体内に挿入し観察して疾患を診断するとともに病態を把握する検査です。通常内視鏡検査と色素を撒くことにより病変を分かりやすくする色素内視鏡検査、ズーム式拡大内視鏡を用いて表面構造を詳細に観察する拡大内視鏡検査があります。
大腸内視鏡検査
大腸で行う色素内視鏡検査では、色素液の凹面へのたまり現象を応用して凹凸を強調させるコントラスト法 (インジゴカルミンなど) や粘膜の分泌物や細胞成分との特異反応を利用する反応法 (クリスタルバイオレットなど) がよく行われます。
拡大内視鏡検査は色素撒布後、あるいは光の波長特性などを用いた観察により、大腸腫瘍の表面微細構造を拡大し、詳細な観察により腫瘍の性質や深達度、範囲を正確に診断する検査法です。現在は通常の大腸内視鏡に組み込まれており簡便に行えるようになっています。 また、病変の一部を採取して顕微鏡で詳しく診断する生検組織検査も同時に行います。
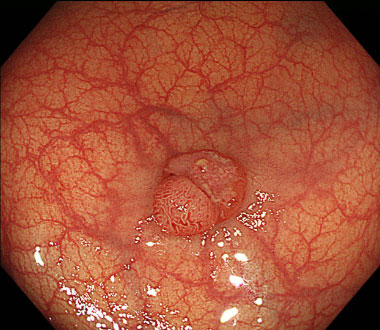
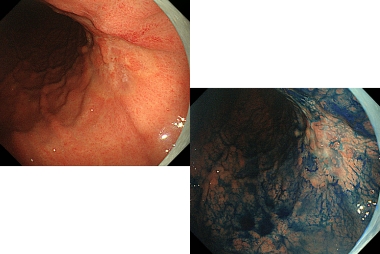
通常光観察。径10mm程度の隆起性病変を認めます。
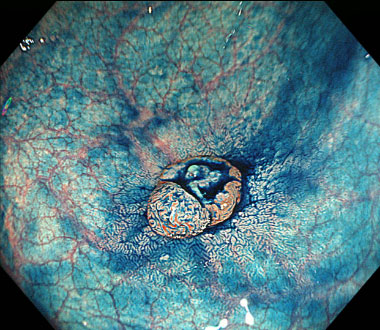
インジゴカルミン撒布像。頂部に陥凹を伴っていることがわかります。
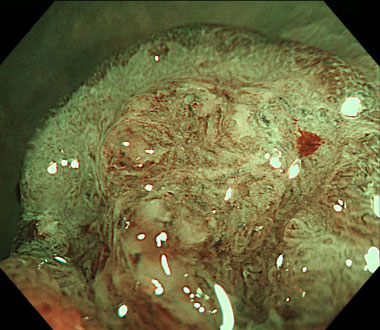
狭帯域光拡大観察。JNET type 3と診断しました。
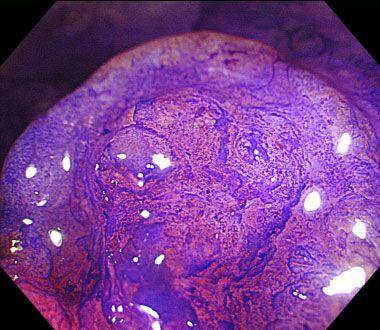
クリスタルバイオレット染色下拡大観察。VI型高度不整〜V N型pit patternと診断しました。以上のことから粘膜下層に浸潤した早期癌と診断しました。
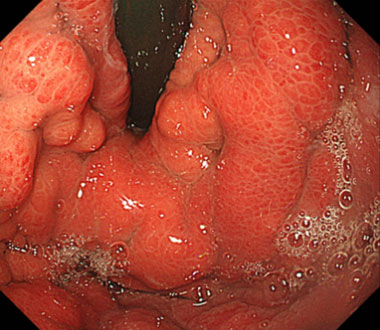
側方発育型大腸腫瘍 (laterally spreading tumor ; LST) とは、肉眼的に側方への腫瘍進展を特徴とする径10mm以上の病変です。LSTは顆粒型 (granular type ; LST-G) と非顆粒型 (non-granular type ; LST-NG) に大別されます。その肉眼的分類はインジゴカルミンを散布して判定します。
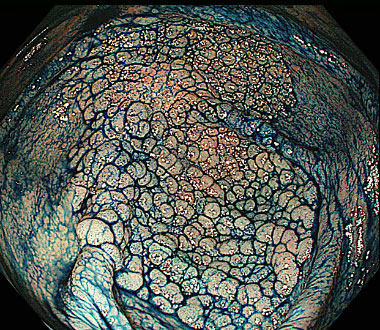
インジゴカルミン散布像 (LST-G 顆粒均一型)
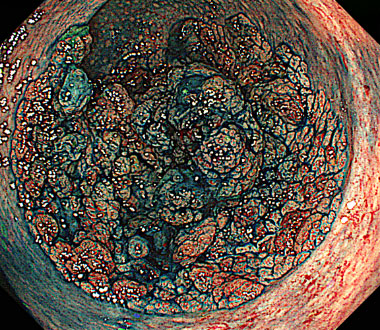
インジゴカルミン散布像 (LST-G 結節混在型)
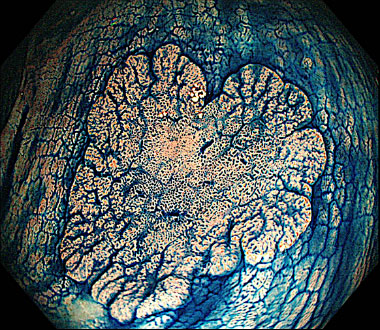
インジゴカルミン散布像 (LST-NG 扁平隆起型)
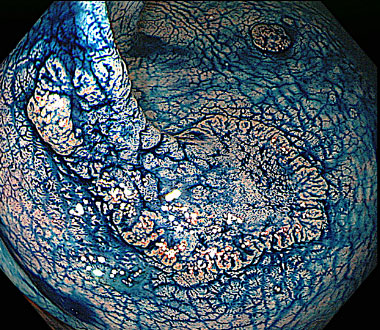
インジゴカルミン散布像 (LST-NG 偽陥凹型)
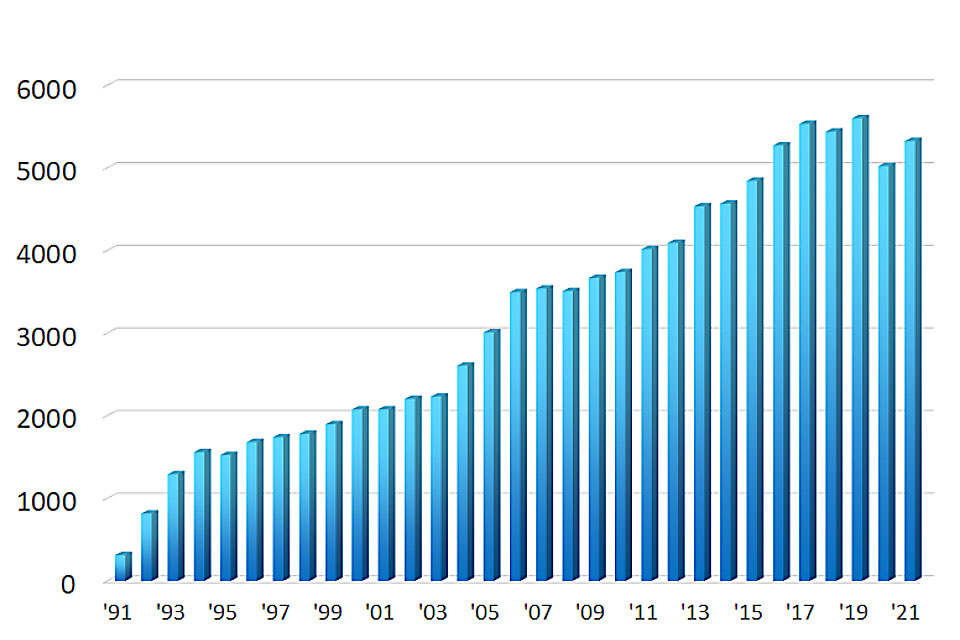
大腸内視鏡検査数
超音波内視鏡検査
超音波内視鏡検査は、生体内において病変の垂直断面像を直接描出する検査法で病理のルーペ像に相当する画像を得ることが可能な検査です。癌の深達度やリンパ節転移、粘膜下腫瘍や壁外圧排の診断が可能です。
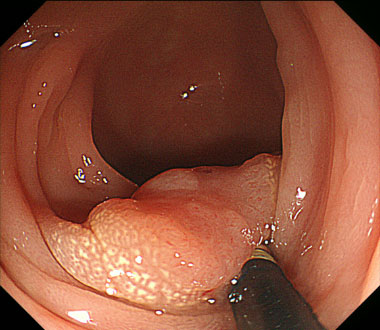
S状結腸、径15mmの隆起性病変を認めます。
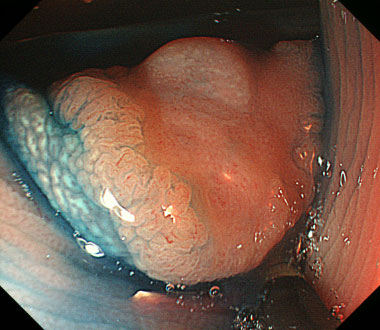
インジゴカルミン散布像により頂部に陥凹を有することがわかります。
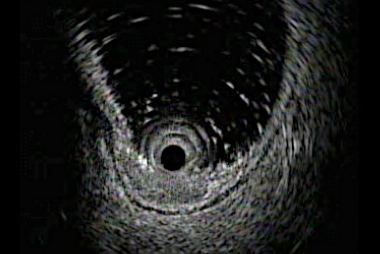
超音波内視鏡像では粘膜下層に腫瘍が浸潤しているのがわかります。
切除生検目的に内視鏡切除が施行され、超音波内視鏡像同様に腫瘍が粘膜下層に浸潤していることが確認されました。
大腸カプセル内視鏡検査
大腸カプセル内視鏡検査は、2014年1月から大腸内視鏡検査が困難な症例に対し使用可能であり、カプセル型の内視鏡を飲み込むだけで大腸内を自動で撮影しながら先進していきます。通常スコープを用いた大腸内視鏡内視鏡と比較し、送気の必要がなく、疼痛も少なく、羞恥心、恐怖感といった心理的な負担も軽減されることが知られています。2020年4月には、適応疾患がさらに拡大され、幅広く使用可能となっています。近年大腸カプセル内視鏡検査の前処置レジメンも工夫され、腸管洗浄度や時間内のカプセル排泄率も向上しつつあり、大腸腫瘍の検出のみならず、潰瘍性大腸炎の病勢評価にも有用であることが報告されています。
大腸カプセル内視鏡に使用する機材

カプセル

レコーダー
ワークステーション
大腸カプセルで撮影された内視鏡画像
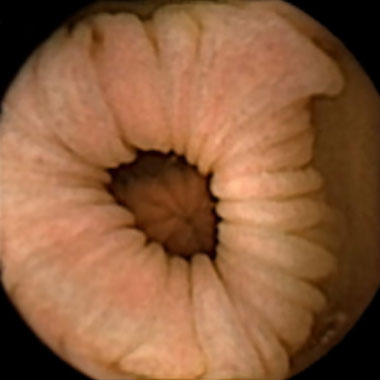
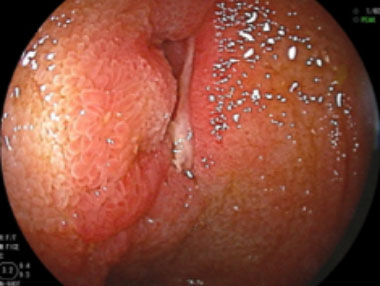
正常粘膜
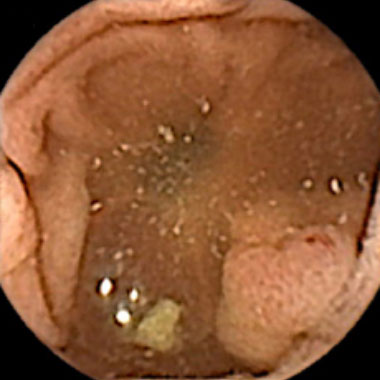
大腸ポリープ
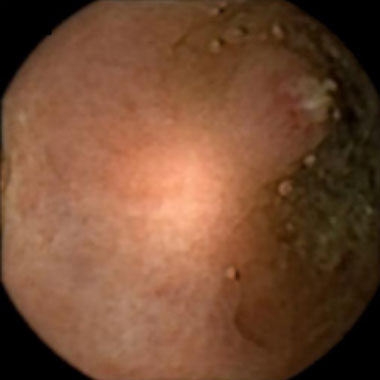
潰瘍性大腸炎
消化管X線造影検査
消化管X線造影検査とは通常はバリウムで造影を行い、透視を行うと同時にX線撮影をして、病変の部位、大きさ、範囲などを診断する検査です。主に食道X線造影検査、胃X線造影検査、小腸X線造影検査、注腸X線造影検査を行っています。その他にも低緊張性十二指腸造影検査なども行っています。
食道X線造影検査
食道X線造影検査ではバリウムを口から直接飲んでもらったり、鼻から挿入した細いチューブよりバリウムと空気を注入して造影像のX線撮影を行います。
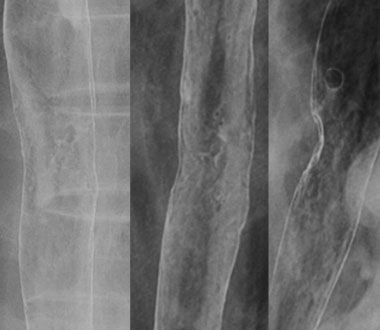
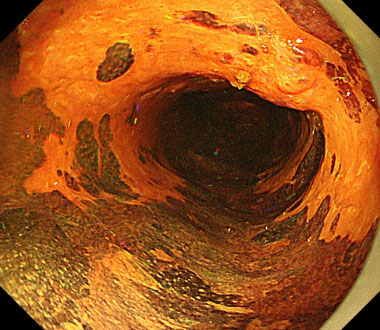
食道癌に対しチューブを用いて撮影した二重造影写真です。
造影写真によりこの病変が粘膜下層まで浸潤した食道表在癌であること、及び病変の範囲、部位がわかります。
胃X線造影検査
胃X線造影検査ではバリウムと発疱剤を口から直接飲んでもらったり、鼻から挿入した細いチューブよりバリウムと空気を注入して造影像のX線撮影を行います。胃の形の異常、胃の辺縁の変化がわかる充盈(じゅうえい)法、バリウムと空気のコントラストの差により粘膜面と壁の変化を表した二重造影法、粘膜面の凹凸や肥厚性変化を表す圧迫法があります。これらの方法を組み合わせて病変の診断を行っています。
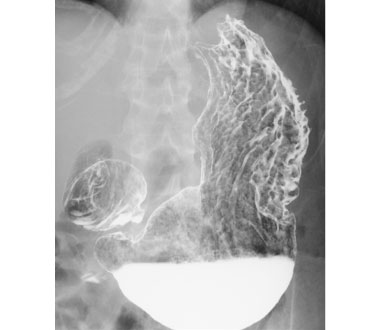
造影写真によりこの病変がスキルス型進行胃癌 (未分化型癌) であること、および病変の浸潤範囲がわかります。
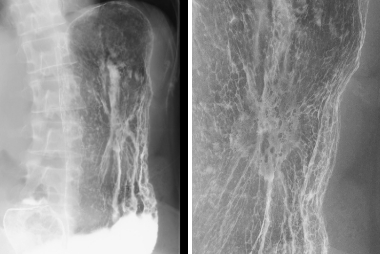
造影写真によりこの病変が早期胃癌 (未分化型癌) であること、及び病変の範囲、部位がわかります。未分化型癌の中でも印鑑細胞癌は、進行すると繊維成分を多く含むスキルス型進行胃癌 (いわゆる“硬い癌”) に進展します。お腹の中に癌細胞が散りやすく (腹膜播種しやすく)、予後が非常に悪い癌とされていますが、早期発見により予後は大きく改善します。
小腸X線造影検査
小腸X線造影検査では、鼻から挿入した細いチューブよりバリウムと空気を注入して造影像のX線撮影を行います。
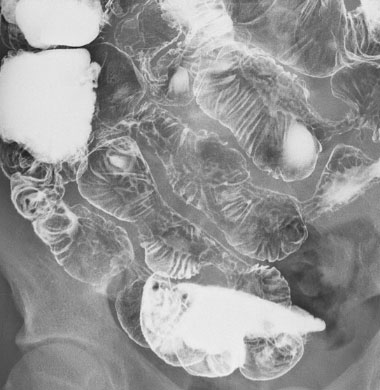
この造影写真では縦走潰瘍が多発し、小腸が偏側性に変形・短縮しておりクローン病と診断できます。
大腸X線造影検査
注腸X線造影検査では肛門から挿入したバルーン付きのチューブよりバリウムと空気を注入して造影像のX線撮影を行います。胃X線造影検査同様、充盈法、二重造影、圧迫法を組み合わせて病変の診断を行います。
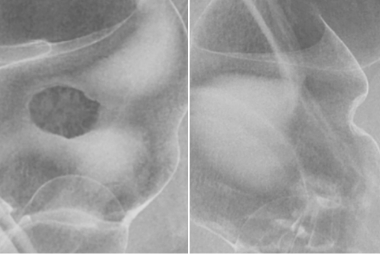
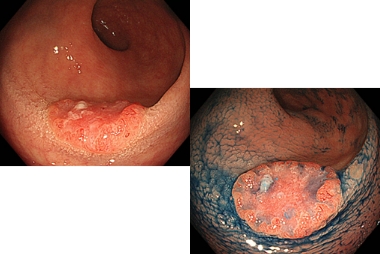
造影写真によりこの病変が粘膜下層に浸潤した早期大腸癌であること、またその病変の範囲、部位がわかります。
消化管内視鏡治療
消化管腫瘍に対する内視鏡治療には様々な種類があります。病変の肉眼型、大きさ、部位などに応じて、最も適した治療法を選択します。
1.ポリペクトミー (Polypectomy)
スネアで絞扼し、高周波電流でポリープを切除する方法です。胃・小腸・大腸における有茎性、亜有茎性ポリープが良い適応です。
孤在性小腸ポリープに対してポリペクトミーを行なった症例
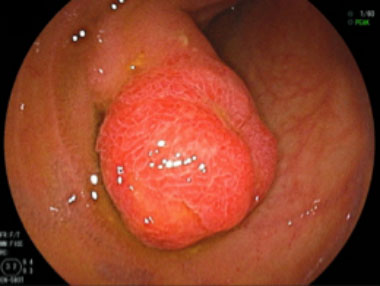
① 空腸に15mm大の発赤調の有茎性ポリープを認めます。
② インジゴカルミンによる色素散布像。
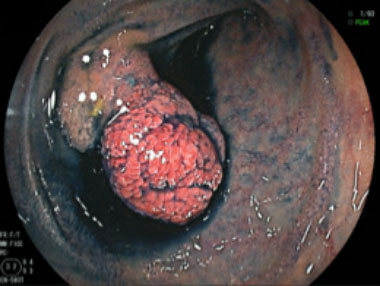
③ 後出血、穿孔予防に根部にポリドカノールを局注しスネアリングを行ないました。

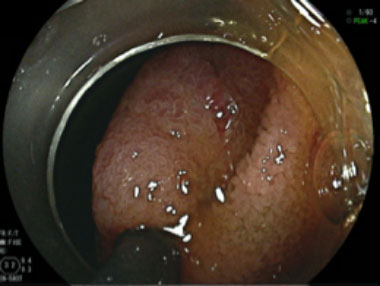
④ 切除後潰瘍底にクリップ留置し処置を終了しました。
2. 内視鏡的粘膜切除術 (endoscopic mucosal resection: EMR)
最もよく用いられる内視鏡治療法です。生理食塩水やグリセオールを粘膜下層 (腫瘍の下と周囲) に注入して人工的隆起を形成し、腫瘍をスネアで切除します。全消化管 (食道・胃・小腸・大腸) における癌や平坦な病変がよい適応です。
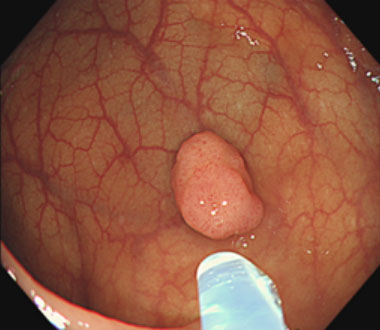
① 径10mm弱のポリープを認めます。
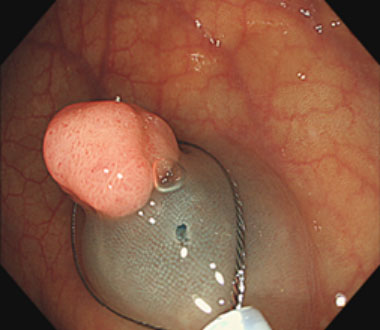
② 粘膜下層に局注液を局注し、スネアをかけます。
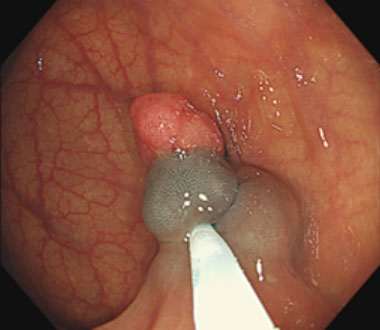
③ スネアを絞扼して、通電して切除します。
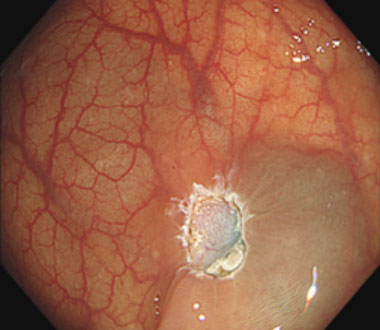
④ 切除後の潰瘍底
3.浸水下内視鏡的粘膜切除術 (underwater endoscopic mucosal resection: UEMR)
消化管の管腔内を水で満たした状態で粘膜下局注を行わずに病変をスネアで絞扼し、通電切除する方法です。消化管内腔を水で満たすと、粘膜・粘膜下層が固有筋層から管腔内に浮かぶ様に突出し、スネアによる絞扼が容易となります。当科では十二指腸腫瘍に対して積極的に行なっています。
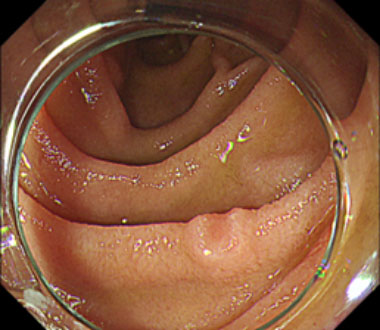
① 十二指腸下行部に径5mmの平坦な病変を認めます。
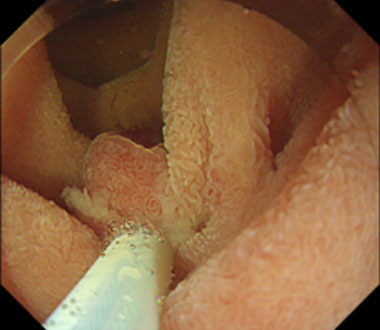
② 浸水下に腫瘍をスネアで絞扼します。
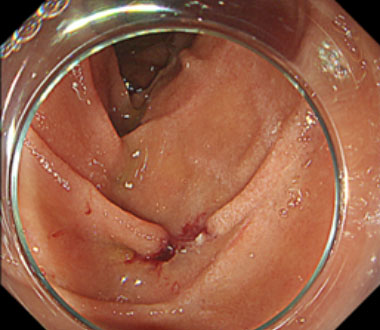
③ 切除後の潰瘍底
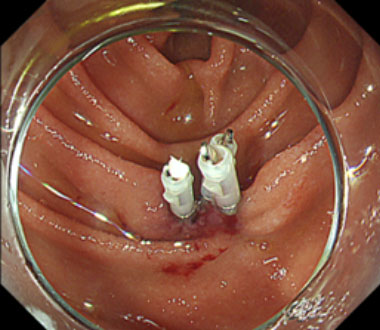
④ 遅発性穿孔予防のためにクリップで潰瘍底を完全縫縮します。
4. 小腸ポリープに対するクリップ留置による阻血治療
小腸ポリープに対する内視鏡的切除には合併症として出血や腸管穿孔が報告されており、近年では通電して切除を行うのではなく、ポリープ根部にクリップを行い、機会的に阻血を行うことで、ポリープを自然脱落させる方法も報告されています。この方法では出血や穿孔といった合併症がほとんどおきません。ただし癌合併が疑われるようなポリープに対して行うと組織学的な診断ができないという難点があります。
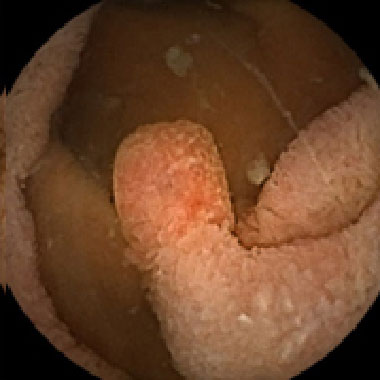
Peutz-Jeghers 症候群の1例
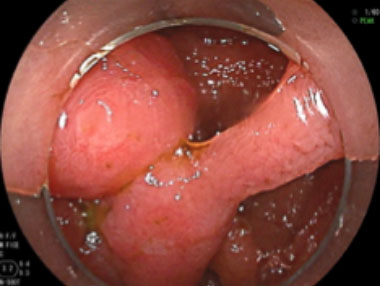
① Peutz-Jeghers症候群により小腸内に有茎性ポリープが多発しています。
② 茎の根部にクリップを1箇所留置した。
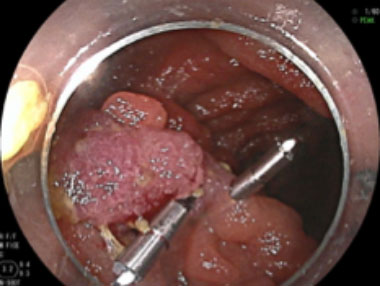
③ クリップをクロスさせるように2箇所留置することで頭部の色調が変化し十分に阻血できていることがわかります。
5. 結紮用デバイスを用いた内視鏡的粘膜下層切除術 (endoscopic submucosal resection with ligation device: ESMR-L)
神経内分泌腫瘍 (neuroendocrine tumor: NET) は腫瘍細胞が粘膜深層より発生し、粘膜筋板を越えて粘膜下層に達して発育するため、EMRでは深部断端陽性となる高くなることが知られています.そのため当科では下部直腸に発生する1cm未満のNETに対して、 食道静脈瘤治療用あるいは大腸憩室治療用のligation deviceを用いたESMR-Lを治療法として選択しています。
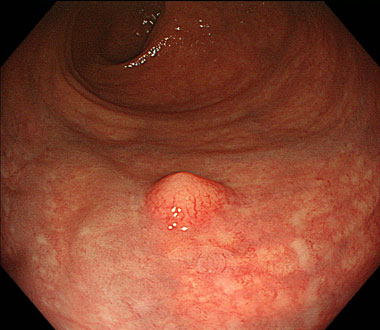
① 下部直腸に径5mm程度の黄色調の粘膜下腫瘍を認めます。
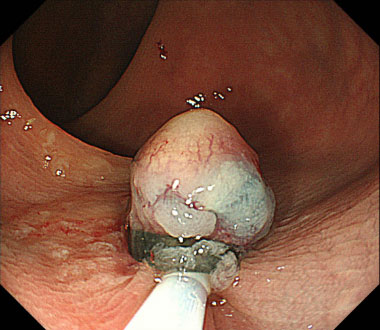
② 腫瘍の根本に結紮バンドを留置し、その直下をスネアにて絞扼します。
③ 切除後潰瘍底です。穿孔をきたすことなく、一括切除可能でした。
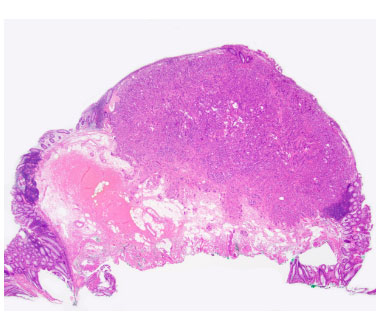
④ 病理標本です。深部断端陰性で切除可能でした。
6.内視鏡的粘膜下層剥離術 (endoscopic submucosal dissection: ESD)
早期の消化管癌に対する治療法として、全国的に普及し保険収載されている治療法です。ESD用に開発された各種デバイスを用いて、大きな病変でも確実に一括切除できる手技です。まず、病変周囲にマーキングを置いたのち、粘膜下層にヒアルロン酸ナトリウム等を局注し病変を挙上させます。次にマーキングの外側の粘膜を切開し、粘膜下層を剥離して病変を切除します。ESD術中に出血を来したり、露出血管を認めた場合には、適宜止血鉗子を用いて凝固止血処置を行い、穿孔を来した場合にはクリップによる縫縮を行います。
食道癌に対するESD
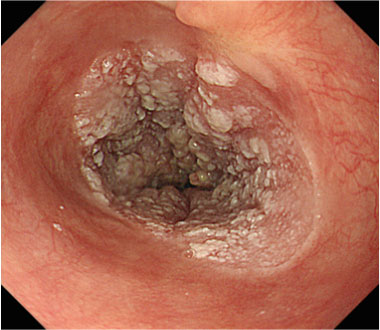
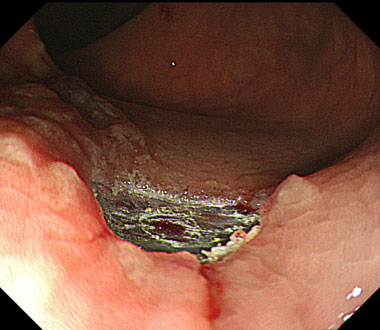
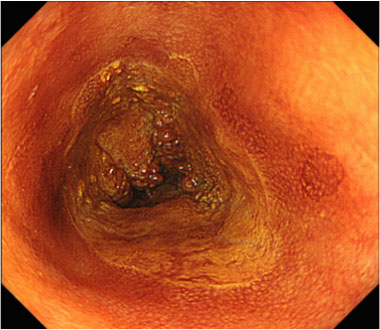
80mm大の全周性食道癌を認めます
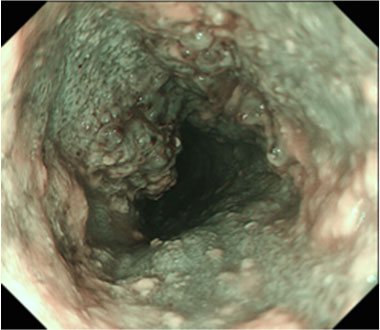
狭帯域光観察像
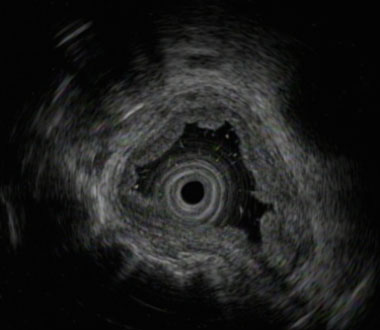
EUSでcEP/LPMと診断しました
ヨード染色像
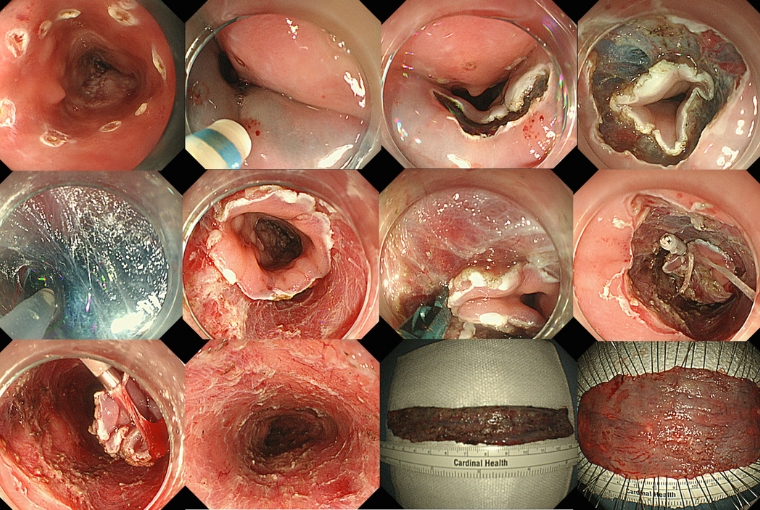
病変の口側と肛門側に全周性にマーキングを行います。マーキング外側の粘膜を切開し、粘膜下層の剥離を行います。途中で糸付きクリップを使用して、病変を引き上げながら粘膜下層を剥離していきます。切除後の潰瘍底は全周性となっています。切除後の病変は筒状となっており、切り開いて病理検査に提出します。
検査実績
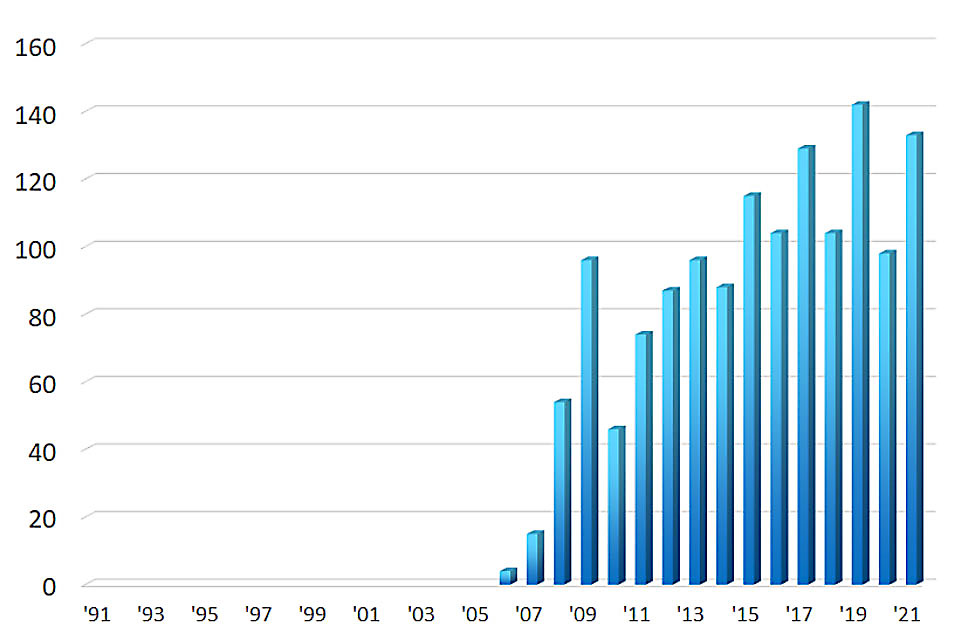
食道ESD件数
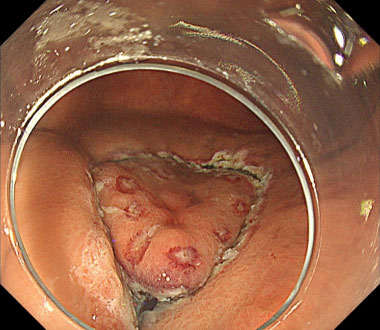
胃癌に対するESD
早期胃癌の中でも粘膜内にとどまる病変は内視鏡切除の適応となります。内視鏡診断および内視鏡切除の進歩に伴い、本邦では胃癌の半数以上に内視鏡切除が行われています。
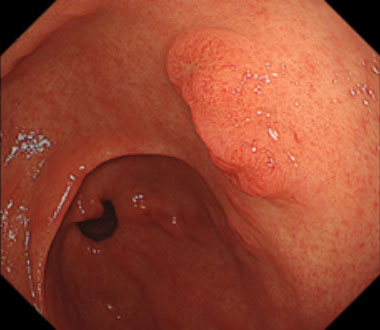
① 前庭部後壁に径10mm程度の隆起性病変を認めます。
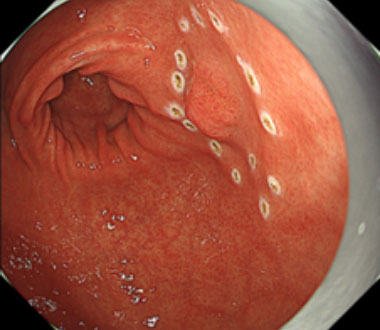
② 病変周囲をマーキングします。
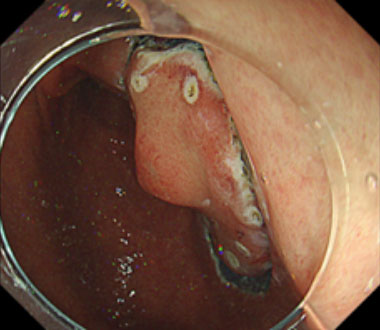
③ まず病変の全周を切開します。
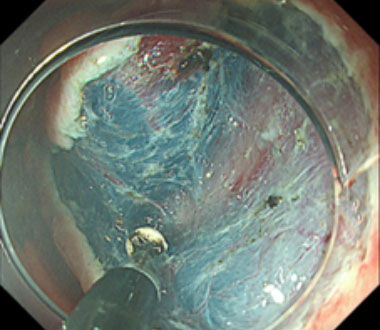
④ 粘膜下層を剥離していきます。
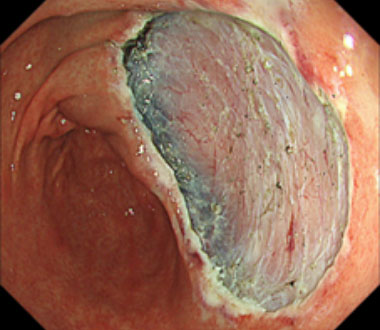
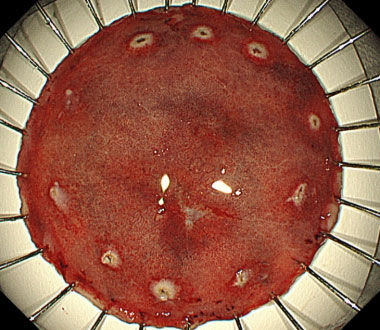
⑤ 切除後の潰瘍底
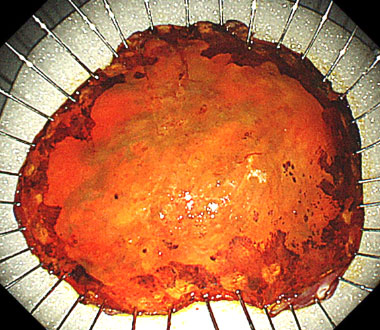
⑥ 切除標本
(1) 糸付きクリップを用いた胃ESD
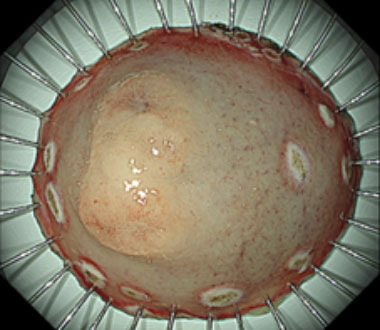
① 胃体下部大弯に30mm大の正色調で平坦な病変を認めます。
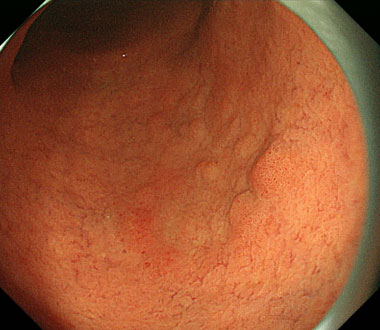
② 全周切開後の粘膜下層剥離の際により良好な視野確保が求められるため
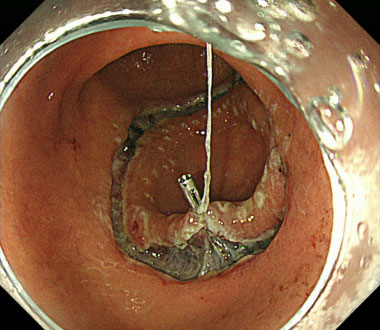
③ 糸付きクリップを用いることでより良好な粘膜下層の視野が確保できます。
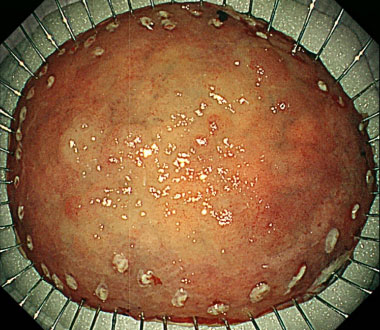
④ 病変を安全に一括切除できました。
(2) ハサミ型ナイフを用いた胃ESD
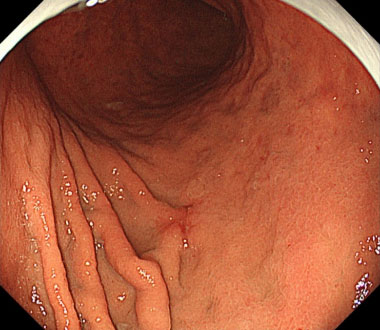
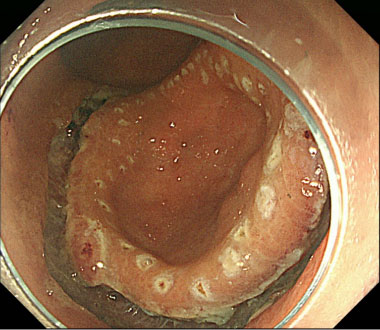
① 胃体中部大弯に10mm大の陥凹性病変を認めます。
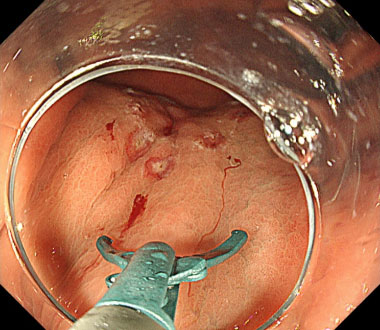
② ハサミ型ナイフを用いることで安全に周辺切開ができます。
③ ハサミ型ナイフで全周切開・剥離を行っていきます。
④ 病変を安全に一括切除できました。
検査実績
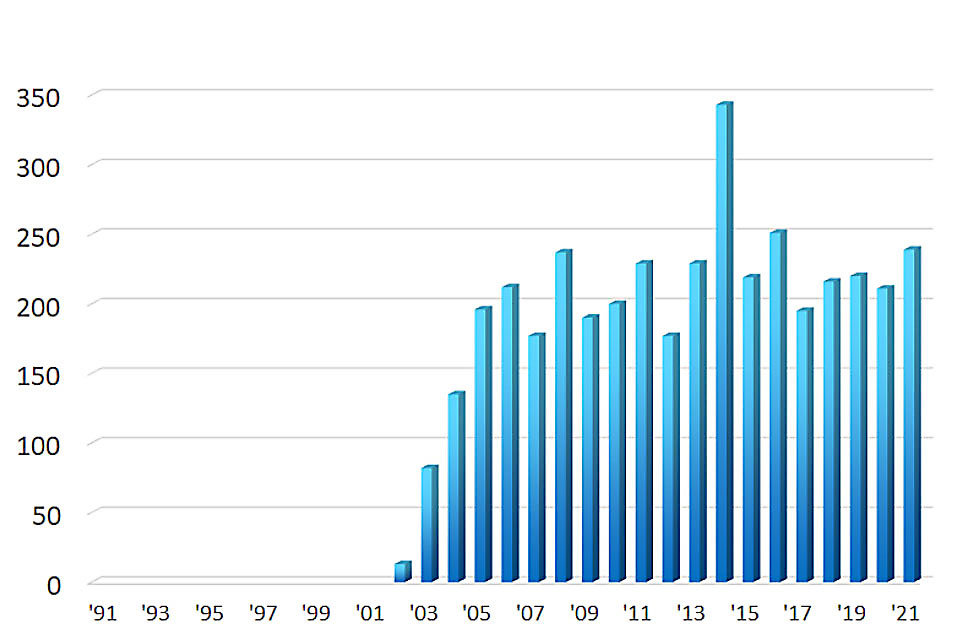
胃ESD件数
大腸癌に対するESD
用語については日本消化器内視鏡学会が作成した「大腸ESD/EMRガイドライン」において以下のように定義されています。
・スネアを併用せず最後まで剥離を完遂したものを狭義のESDと定義する。
・ESD用ナイフあるいはスネア先端を用いて病変周囲切開後、粘膜下層の剥離を全く行わずにスネアリングを施行する手技を「Pre-cutting EMR」と定義する。
・ESD専用ナイフあるいはスネア先端を用いて病変周囲切開後、粘膜下層の剥離操作を行った後にスネアリングを施行する手技を「Hybrid ESD」と定義する。
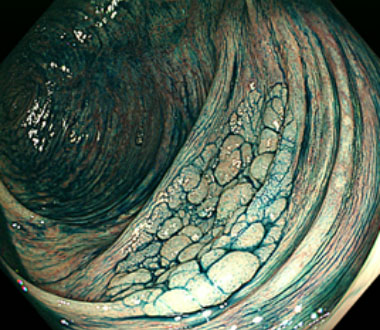
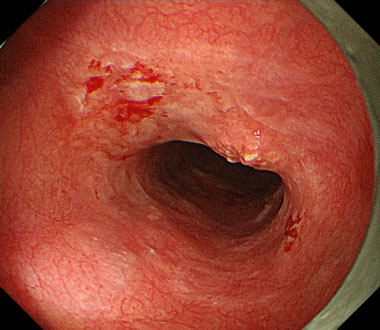
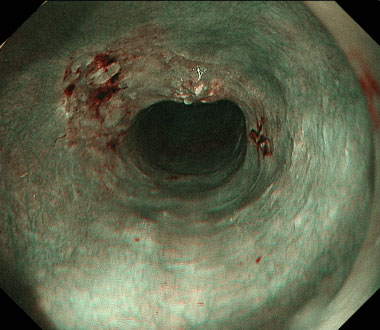
① 上行結腸に30mm大の隆起性病変を認めます。色素散布で病変境界は明瞭に観察されます。
② 病変直下の粘膜下層に局注液を注入し、病変周囲の粘膜を切開します。
③ 局注液を追加しながら、粘膜下層を剥離していきます。
④ 一括切除後の潰瘍底
検査実績
大腸ESD件数
7.内視鏡的咽喉頭手術 (endoscopic larygopharyngeal surgery: ELPS)
咽喉頭領域における鏡視下手術です。喉頭展開を行って経口的に鉗子を挿入し、内視鏡補助下に上皮下層剥離を施行します。当科では当院耳鼻科と定期的に治療適応病変のカンファレンスを行い、合同で手術を行なっています。
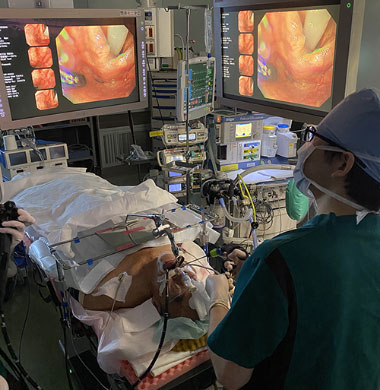
ELPS治療時の全景
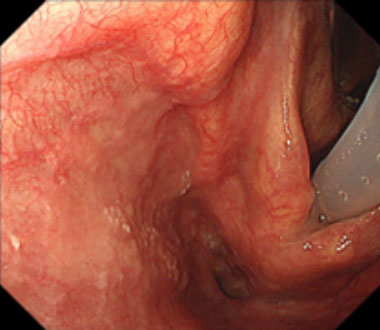
① 左梨状窩に径20mm大の陥凹性病変を認めます。
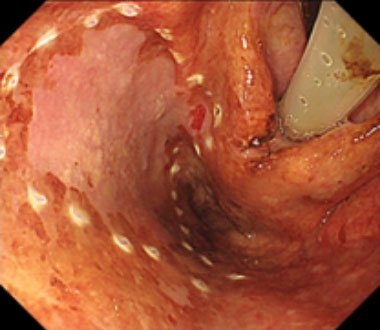
② 病変周囲にマーキングを行います。
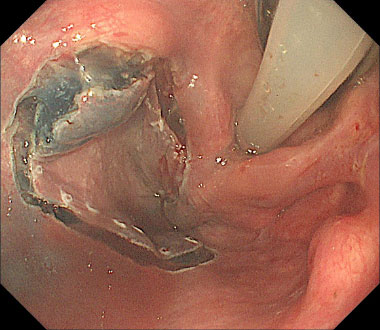
③ 病変の周辺切開を行います。
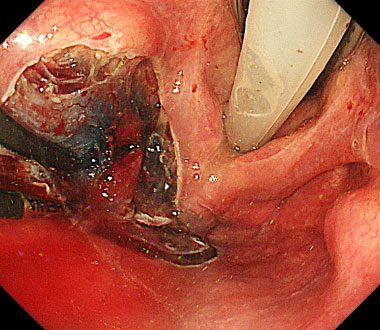
④ 上皮下層を剥離していきます。
⑤ 切除後潰瘍底
⑥ 切除標本
8. 消化管拡張術
消化管狭窄は内視鏡治療後の瘢痕狭窄、外科手術後の吻合部狭窄、クローン病によるものなど原因は様々です。当院では内視鏡的バルーン拡張術、Radical incision and cutting (RIC) などを行っています。
小腸狭窄に対する内視鏡的バルーン拡張術 (Endoscopic balloon dilation: EBD)
小腸は管腔が狭く、慢性的な炎症に伴い管腔が狭窄をきたすことが知られています。とりわけ小腸に慢性的な炎症を起こすことで知られている炎症性腸疾患であるクローン病は小腸の狭窄をきたすことが良く知られています。繰り返す外科手術により小腸の長さがどんどん短くなっていくことで、栄養吸収が十分にできなくなる短腸症候群といった不可逆的な病態を起こすこともあり、いかに外科手術を少なくするかということが重要とされています。現在、内視鏡技術の発達に伴い、小腸内視鏡を用いた内視鏡的バルーン拡張術 (EBD) も可能となってきており、外科手術の回数を減らすことができることがわかってきました。
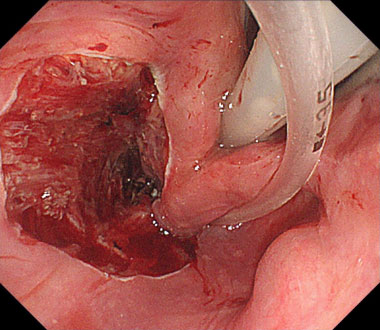
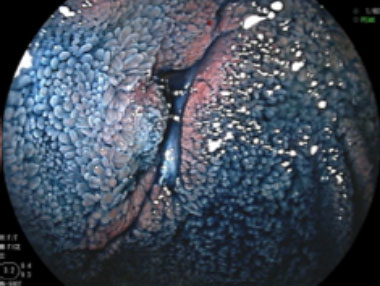
クローン病に伴う小腸狭窄症例
クローン病に伴う狭窄を認めます。
インジゴカルミンによる色素散布像
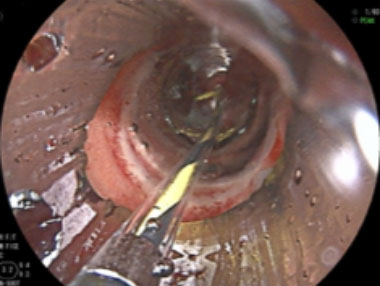
拡張用バルーンカテーテルを用いたバルーン拡張術
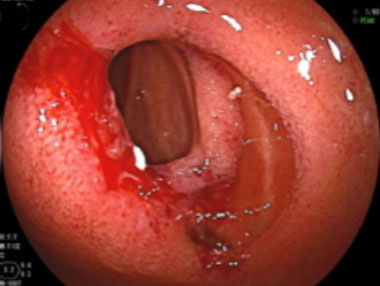
バルーン拡張により裂創が形成され、管腔の拡張が得られています。
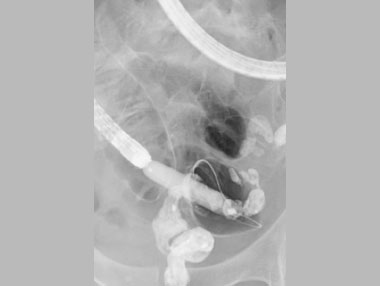
X線透視下でのバルーン拡張術。X線でバルーンの拡張程度を確認しながら治療を行います。
悪性リンパ腫化学療法後の瘢痕性狭窄に対し、キャストフードを用いた拡張例

キャストフード
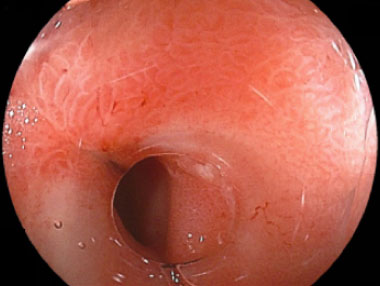
狭窄部に対しキャストフードを用いた内視鏡像。先端が先細りになっていることで、狭窄部内腔の視認が容易となります。また先端にメモリがついていることで狭窄径の客観的評価が可能です。
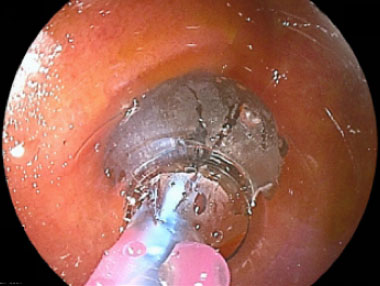
先端が先細りになっていることで、バルーンカテーテルの誘導も容易となります。拡張後のスコープ通過も先端が先細りになっていることで容易です。
9. 内視鏡的消化管止血術
上部消化管病変に対する内視鏡的止血術
潰瘍や炎症などによって消化管粘膜が損傷しておこる出血を止める手技の総称です。高周波電源を用いた熱凝固やクリップを用いた機械的止血法があります。
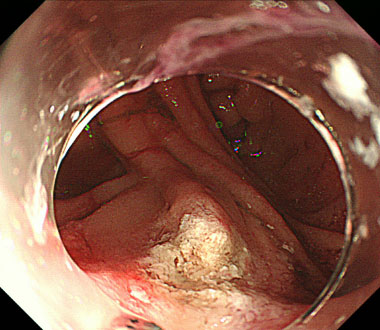
食道小腸吻合部に生じたDieulafoy潰瘍に対する熱凝固止血
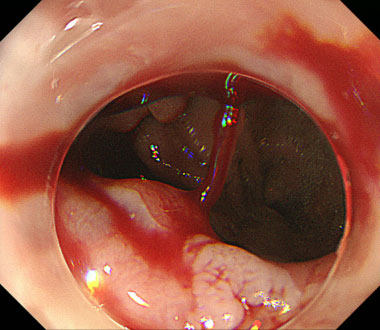
①吻合部に生じた消化管の粘膜下を走行する血管の破綻により生じたDieulafoy潰瘍から噴出性出血を認めました。
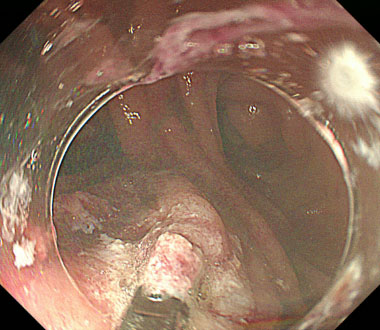
②止血鉗子を用いて、出血点を把持した状態で高周波電流を通電することにより、焼灼凝固および止血を行いました。
③内視鏡的止血術を行った後の潰瘍ですが、血管は消失し止血が得られました。
胃粘膜下層内の穿通枝に対する機械的止血
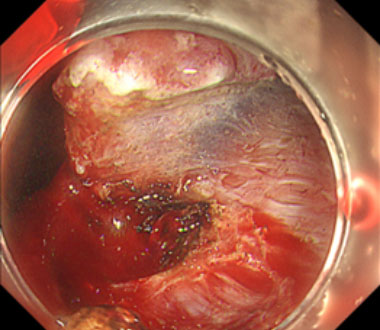
①内視鏡的粘膜下層剥離術中に穿通枝という太い血管から出血を認めました。白色光ではやや出血点の同定が困難でした。
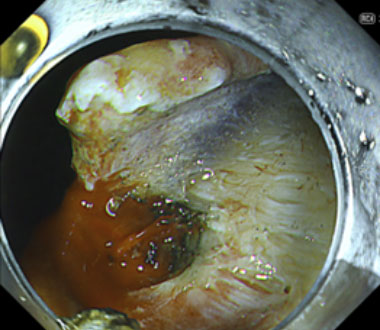
②琥珀色の光を用いて色調を変化させる強調画像によって、赤い血液は黄色となり濃淡によって活動性出血の部位が明瞭となりました。
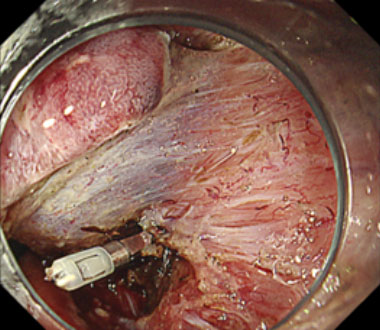
③出血している血管をクリップで直接捕捉することで止血を得ました。
小腸病変に対する内視鏡的止血術
小腸からの出血は、全消化管出血のうち5%程度と報告されています。当院では主に止血剤としてポリドカノールという薬剤の局所注射、APCプローべによる焼灼、クリッピングによる機械的止血術を組み合わせて治療を行なっています。
小腸angioectasiaからの出血に対する内視鏡治療
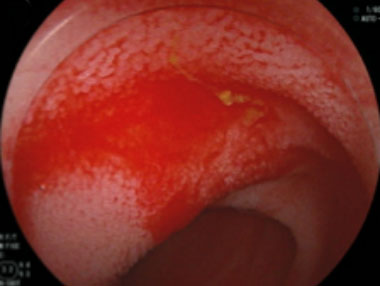
①空腸のangioectasiaから出血を認めます。
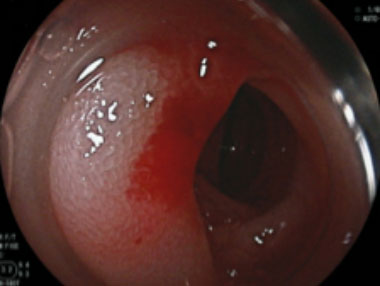
②病変直下にポリドカノール0.5ml局注を行ないました。
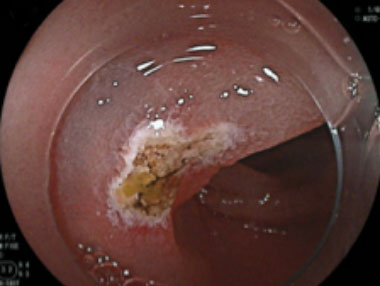
③その後angioectasiaに対しアルゴンプラズマレーザーで焼灼止血を行ないました。その後は再出血なく経過しています。
大腸病変に対する内視鏡的止血術
憩室とは消化管壁の一部が外側に突出し、嚢状になった状態をいいます。
憩室内の血管が貯留した便によって傷つけれられて出血すると、時に憩室出血を起こし突然の血便の原因となります。
大腸憩室出血対するバンド結紮術 (Endoscopic Band Ligation:EBL)
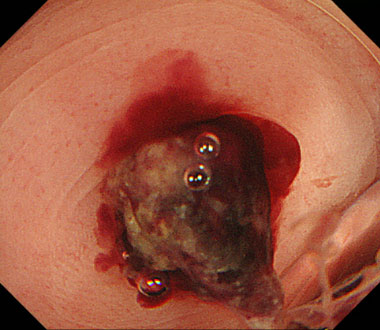
① 憩室にコアグラ (血の塊) が存在し、その周囲から出血しています。
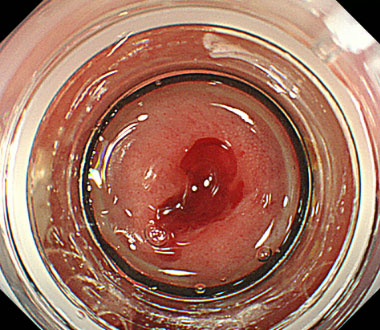
② 憩室を内視鏡の先端につけたフード内に吸引します。
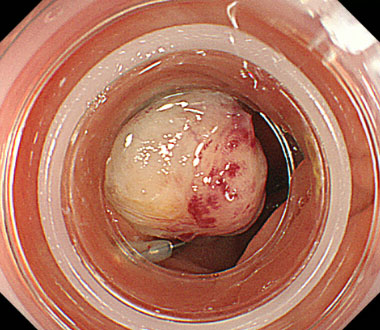
③ 吸引後に憩室の根本をバンドで結紮し、止血が得られました。
直腸潰瘍に対してポリグリコール酸シートを固定した症例
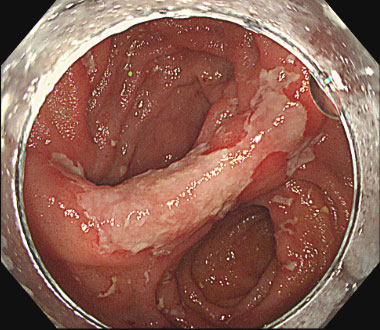
① 直腸術後吻合部潰瘍を認めます。本症例は出血を繰り返し、難治症例でした。
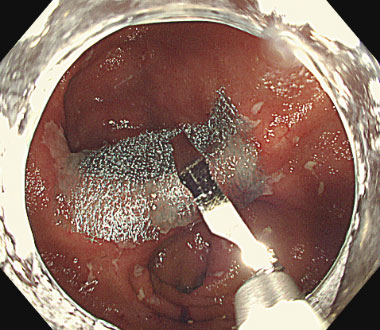
② ポリグリコール酸シートを貼付し、クリップで固定しました。
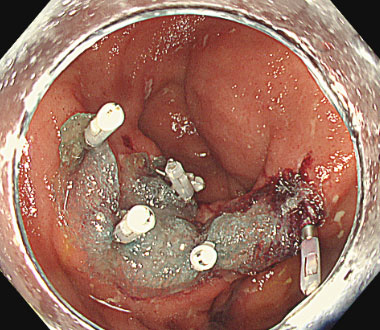
③ 固定後の潰瘍底。以後出血は認めませんでした。
10. 消化管穿孔に対する内視鏡治療・穿孔予防縫縮
ESDなどの内視鏡治療時に、止むを得ず消化管壁に穴があくことがあります。その際はクリップなどで穿孔部を縫縮します。
また潰瘍底が薄い場合、補強のために縫縮を行うこともあります。
胃ESD後遅発性穿孔に対してポリグリコール酸シートを充填した症例
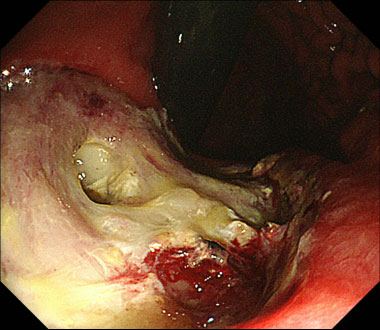
内視鏡的粘膜下層剥離術後に遅発性穿孔を認めた症例で、胃体下部小弯の治療後潰瘍に穿孔所見を認めました。
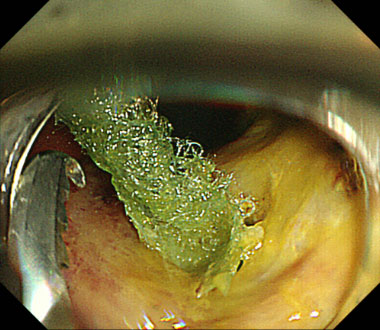
穿孔部にPolyglycolic acid sheetを充填し閉鎖しました。保存的加療のみで軽快退院されました。
胃ESD後潰瘍に対して留置スネアを用いてを縫縮した症例
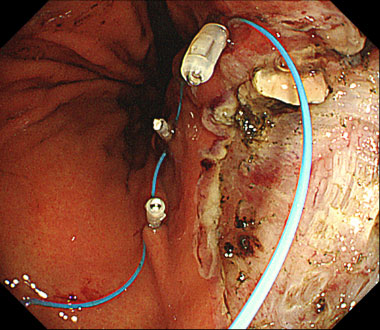
巨大な内視鏡的粘膜下層剥離術後潰瘍に対して、留置スネアというプラスチックのひも状の輪をクリップで正常粘膜に固定します。
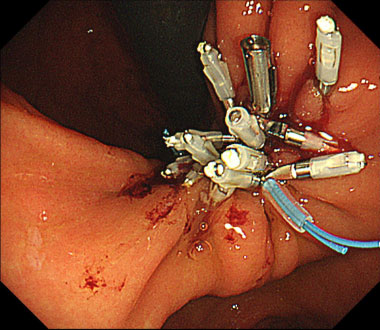
全周性に固定した上で、最終的に牽引することで潰瘍が巾着の様になり完全縫縮されました。その後、出血や遅発性穿孔などの偶発症なく軽快退院されました。
大腸ESD時の穿孔に対してクリップにて縫縮した症例
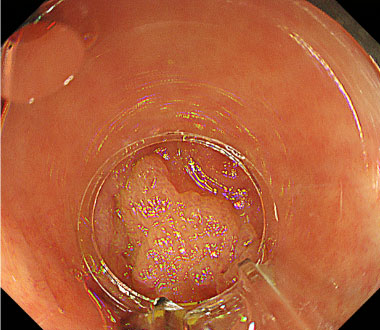
① 内視鏡の操作性が悪く、病変を画面の真正面に認めています。
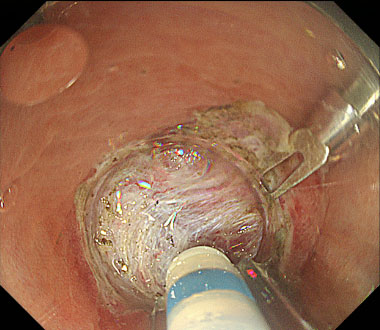
② ESD中、粘膜下層に強い線維化を認めました。
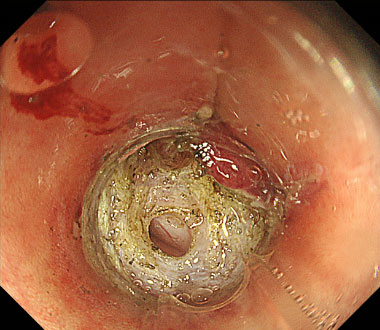
③ 穿孔をきたし、腸管外が見えています。
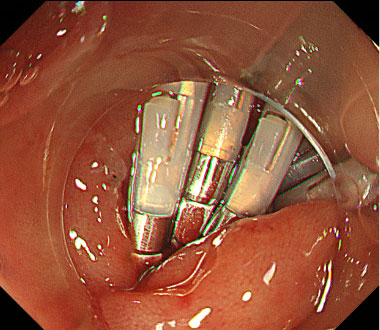
④ クリップにより穿孔部を完全に縫縮しました。
11. 内視鏡的消化管異物除去術
乾電池をスネアにて除去した症例
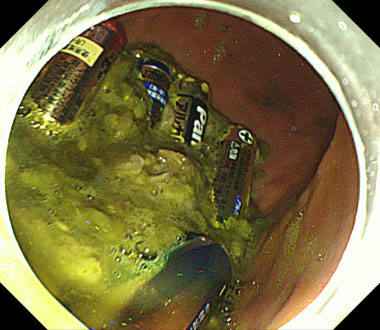
自殺企図で乾電池を計10本異食したため救急搬送となり、異物除去目的に緊急内視鏡を行った症例です。
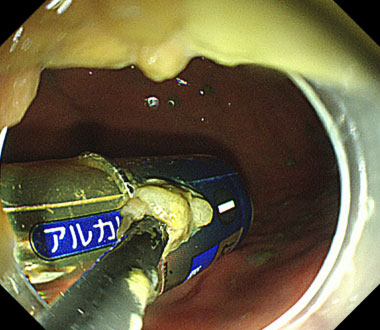
スネアという金属の輪を用いて乾電池を1つずつ把持し、そのままスコープごと抜去し、除去をしていきました。
魚骨を把持鉗子にて除去した症例
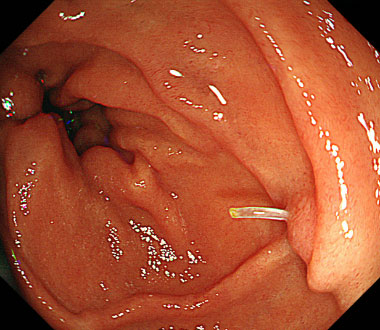
① 十二指腸下行部後壁に魚骨が刺入していました。
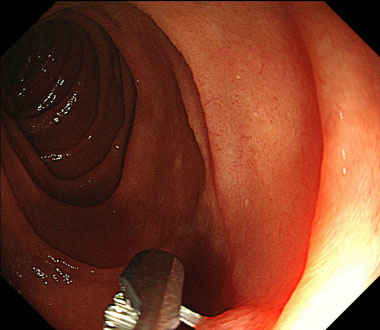
② 把持鉗子にて魚骨を直接把持し、除去するためにけん引していきました。
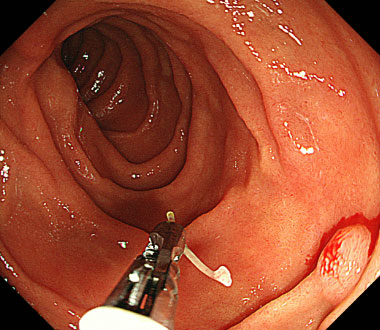
③ 無事に除去することに成功し、特に偶発症は生じませんでした。
消化管腫瘍の化学療法
近年のがん治療の進歩は目覚ましく、手術で切除できない進行がんに対して、化学療法(抗がん剤治療)、免疫療法、放射線療法を適切に組み合わせることによって、生活のクオリティを保った長期生存が可能なケースが増えています。
当科では、食道癌、胃癌、十二指腸癌、小腸癌、大腸癌などに対して、多数の消化器内科専門医、がん薬物療法専門医、外科医、放射線治療医が緊密に連携し、最善の治療法を提供できるよう、ケースごとにディスカッションしています。
早期からゲノム医療 (がん遺伝子パネル検査) を開始し、治験を含めた治療選択肢が増えるように工夫しています。また国内の大規模臨床試験グループに所属し、最新の臨床試験に参加できる機会を増やしています。がんを減らす積極治療が難しくなる時期には、緩和ケアも重要な医療の内容となります。院内緩和ケアチーム、連携病院あるいは在宅かかりつけ医との頻回にやりとりし、切れ目のない安心できる医療を提供できるように努めています。
食道癌
広汎なリンパ節転移を有する切除不能食道癌で、食物の通過障害がありました。導入化学療法ののち、化学放射線療法を行いました.病変は消失し、症状は改善しています。
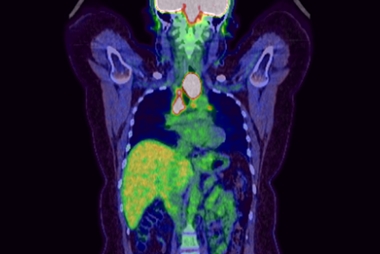
治療前
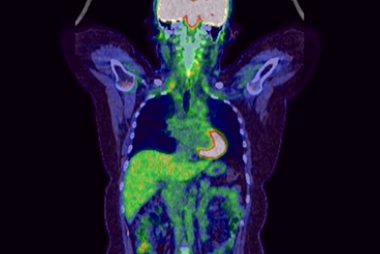
治療後
胃癌
多発肝転移を有するステージ4の胃癌で、病変からの出血のため高度貧血を生じていました。
1年6ヶ月の化学療法ののち、免疫療法に変更し、肝転移は消失し、原発巣も縮小しています。
貧血は改善し、診断から2年間、体重の減少なく元気に通院治療されています。
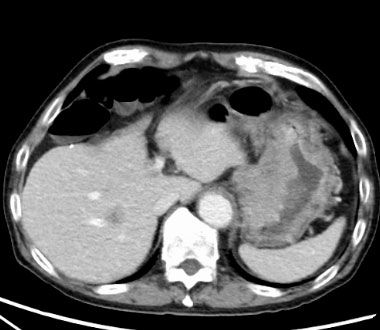
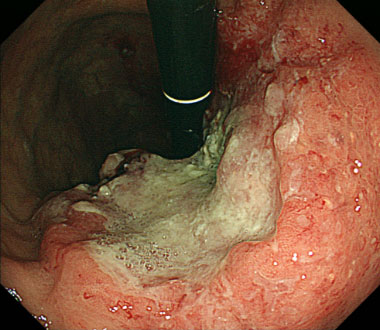
小腸癌
腸閉塞で発症し、素早く診断したのち、原発巣を切除しました。手術では取りきれないリンパ節転移に対して、化学療法を開始しました。途中、がん遺伝子パネル検査で免疫治療が可能と診断されたため、治療法を変更しました。
その後、転移性病変は消失しています。
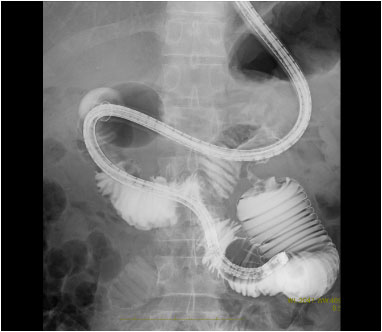
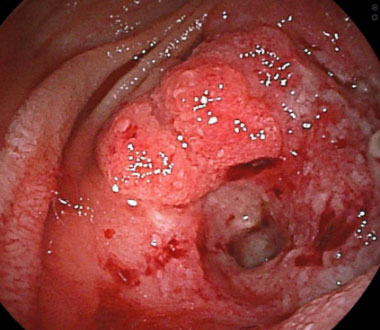
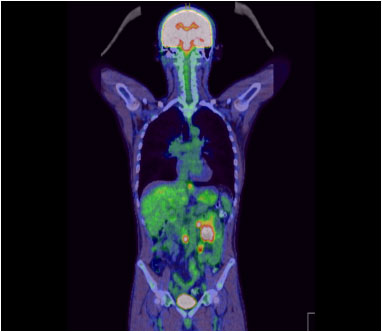
大腸癌
多発肝転移を伴う結腸癌に対して、化学療法を開始し、病変を制御しました (治療後には血流が乏しくなった肝転移が黒っぽく変化している)。がん遺伝子パネル検査で免疫治療が可能と診断されたため、治療法を変更し、抗がん剤の副作用が軽減しました。
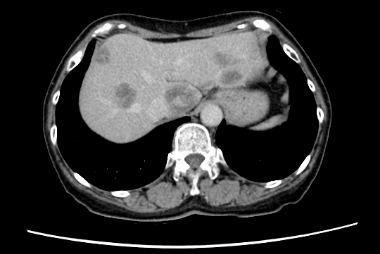
治療前
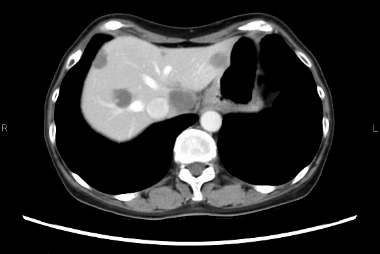
治療後
炎症性腸疾患
炎症性腸疾患(Inflammatory Bowel Disease; IBD)は慢性の下痢、腹痛や下血を来す疾患群で狭義では潰瘍性大腸炎(UC)とクローン病(CD)に分類されます。
IBDは遺伝的素因・腸内細菌・食事などの環境因子によって生じる過剰な免疫反応が原因と考えられています。元々は欧米に多い疾患でしたが、日本でも21世紀に入り患者数は増加しており、現在UCは22万人、CDは7万人を超えています。若年者に多く難治であり、完治させることは困難ですが、ここ数年で様々な内科的治療法が加わり、入院や手術を回避し、長期に寛解維持できる症例が増えています。
IBDの診療体制について
現在、当院の消化器内科にはUCとCD合わせて約1000人の患者さんが通院しています。
当院の診療の特徴として、再燃時や経過観察時には負担のない体外式超音波検査やカプセル内視鏡検査を励行していること、必要時には質の高い大腸内視鏡検査やダブルバルーン小腸内視鏡検査を行うことが可能であることも挙げられます。
また、2015年7月よりIBDセンターを設置し、様々な診療科や多職種による連携により、より質の高いIBD診療を提供できる体制を整えています。
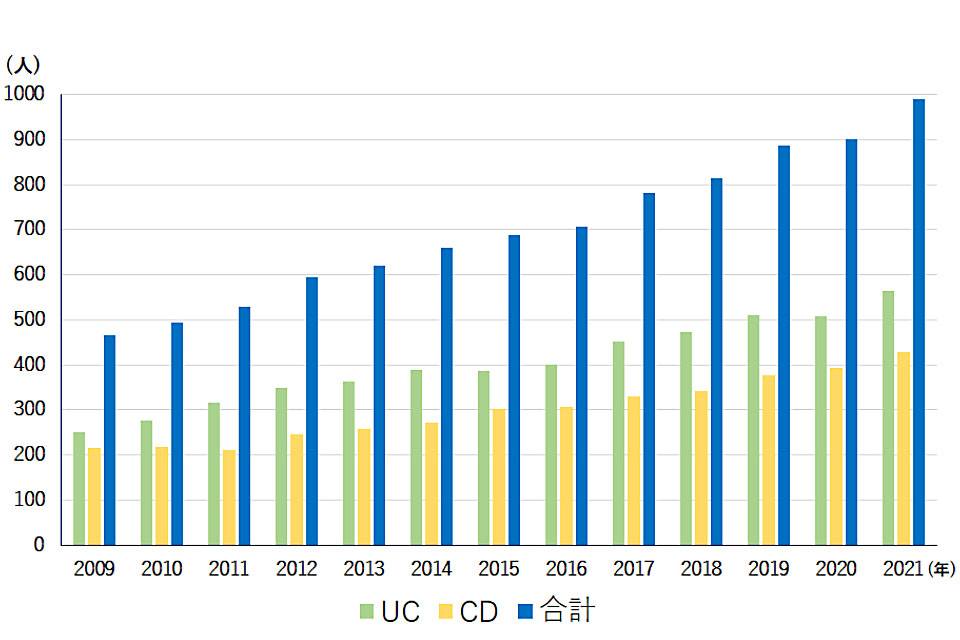
当院IBD症例数
IBDの内科的治療について
IBDの原因は不明であり、残念ながら今のところ病気を完全に治癒させる薬はありません。しかし、ここ数年、症状を改善させ (寛解導入)、症状のない落ち着いた状態を保つ (寛解維持) ための内科的治療が充実してきています。
最近は図2にように粘膜治癒の認められた患者さんでは入院の機会や手術を回避する確率が上昇すると報告されており、症状をなくすだけでなく粘膜治癒を目指した治療戦略が推奨されています。
しかし全ての患者さんに生物学的製剤や免疫調節剤を最初から投与することはありません。当院では個々の患者さん毎に有効性と安全性を考慮したバランスの良い治療を提供できるよう心掛けています。
潰瘍性大腸炎の治療
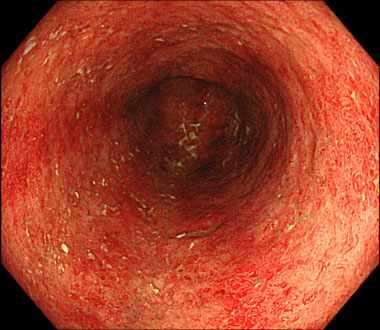
治療前
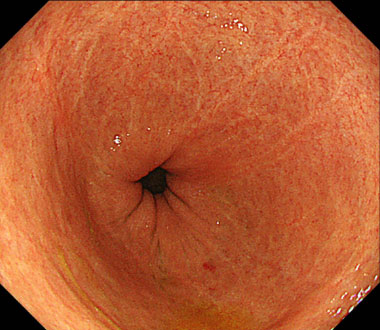
治療後
クローン病の治療
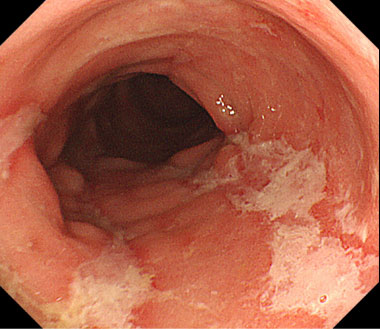
治療前
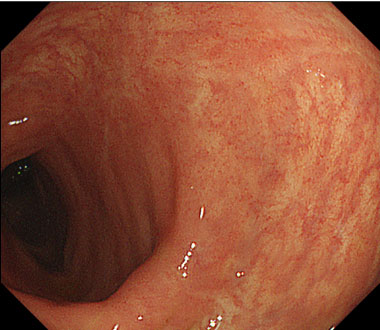
治療後
IBDの内科的治療法
| 治療法 | UC | CD |
|---|---|---|
| 栄養療法 | × | ○ |
| 5-ASA製剤 | ○ | ○ |
| 副腎皮質ステロイド製剤 | ○ | ○ |
| 免疫調整薬:アザチオプリン | ○ | ○ |
| 血球成分除去 (CAP) 療法 | ○ | × |
| 局所製剤:坐剤、注腸 (5-ASA、ステロイド) | ○ | × |
| カルシュニューリン阻害剤:タクロリムス | ○ | × |
| 抗TNFα抗体製剤:インフリキシマブ、アダリムマブ | ○ | ○ |
| 抗TNFα抗体製剤:ゴリムマブ | ○ | × |
| 抗IL-12/23p40抗体製剤:ウステキヌマブ | ○ | ○ |
| 抗IL-23p19抗体製剤:リサンキツマブ | × | ○ |
| 抗α4β7インテグリン抗体製剤:ベドリズマブ | ○ | ○ |
| JAK阻害剤:トファシチニブ、フィルゴチニブ、ウパダシチニブ | ○ | × |
| α4インテグリン阻害剤:カロテグラストメチル | ○ | × |
このように近年IBDに対して使用可能な薬は多岐にわたっており、それぞれに様々な特徴があります。患者様の状態に応じて、最も適した治療薬の選択を行えるように心掛けております。IBDの領域は新規薬剤の開発も目覚ましく、当院では治験や臨床研究も行っており、治療の選択肢が広いのも一つの特徴です。
IBDの外科治療
内科的治療に反応の乏しい難治例や、大量下血、腸管穿孔、癌の合併がみられる症例では外科治療が必要となります。また腸閉塞を繰り返す狭窄例や、ステロイド長期投与による副作用の発現は、相対的な手術適応となります。このような患者さんに対しては、当院消化器外科と連携をしながら診療にあたっています。



