新しい内視鏡機器、診断学
新しい内視鏡を用いて、新たな診断学・治療を開発しています。また、消化管腫瘍の粘膜切除に関して、内視鏡的粘膜下層剥離術(ESD)を積極的に行い、臨床成績を構築中です。手技に関する新たな工夫や、新たな機器を用いた診断・切除成績および有用性を報告しています。近年では人工知能(Artificial Intelligence: AI)を用いた内視鏡診断の開発にも力を入れています。
新しい小腸内視鏡
新型シングルバルーン内視鏡
2021年2月に新型シングルバルーン小腸内視鏡が本邦で発売されました。内視鏡に装着したスライディングチューブの先端にあるバルーンと内視鏡のアングル操作により、腸管を短縮しながら小腸の深部へと挿入していきます。従来のシングルバルーン内視鏡と比較し鉗子孔径 3.2mmに拡大し、内視鏡の画質もより高画質となっていることが特徴です。また、最新の画像強調内視鏡技術を有し、小腸病変の視認性向上が期待されます。
新型小腸内視鏡
システム

内視鏡本体
新型小腸内視鏡を用いた内視鏡的止血術 (Dieulafoy’s lesion Type 2aからの出血例)
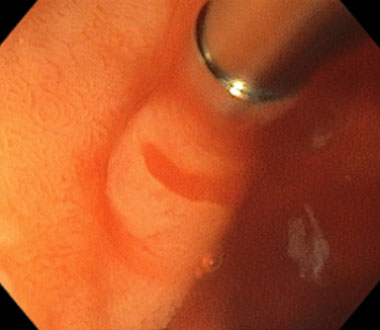
白色光観察
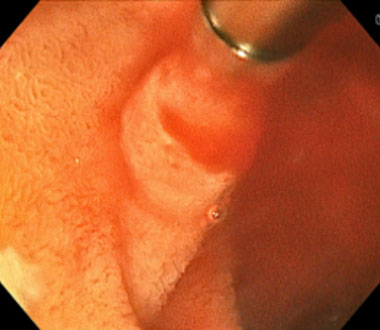
構造強調画像
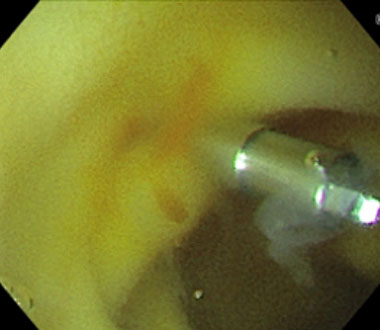
特殊光観察により血液が黄色に描出されています
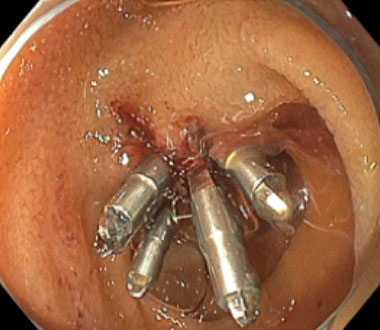
クリップとポリドカノールを用いた止血術を行いました。
新型ダブルバルーン内視鏡
2024年5月に発売された新型ダブルバルーン内視鏡 EN-840Tは高解像度CMOSセンサーを搭載することで、従来機種と比較し高解像度の内視鏡画像の撮影を可能にし、さらにBLI (blue laser imaging)やLCI (linked color imaging)といった画像強調内視鏡観察により病変の視認性向上が期待されます。また、同時にLED光源搭載内視鏡システムの新モデル「ELUXEO 8000システム」を導入し血液の色の濃淡や微妙な色の違いを強調し、出血時の出血点検出のサポートが期待されるACI (amber color imaging)も使用可能です。さらにEN-840Tは高弾発グラデーション軟性部を採用し、従来機種と同等の先端部径、鉗子口径を維持し従来機種と比較し挿入性・操作性がさらに向上することが期待されます。
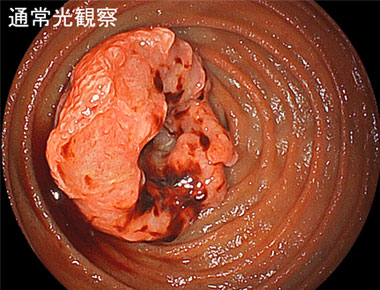

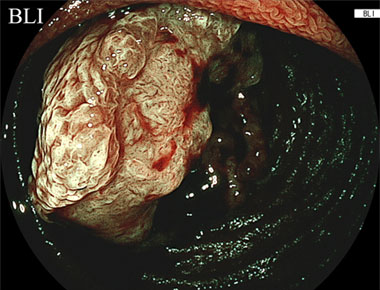
またこちらは原発性小腸がんの症例ですが、白色光観察と比較すると、LCIでは病変の発赤がより明瞭かし、BLI観察では病変内部の不正な表面構造、血管構造がより明瞭に肝観察できることがおわかりいただけるかと思います。
新しい小腸カプセル内視鏡検査
2021年1月より本邦で使用可能となった新型のカプセル内視鏡は4台のカメラが内蔵されることで、視野角が360度に近いパノラマ撮影が可能となっています。また、カプセル内部にフラッシュメモリを有することで、従来のカプセル内視鏡に必要であった体外受信機が不要となっており、検査中も従来通りの日常生活を送ることが可能となっています。また、体外受信機が不要であることから、以前には検査が不可能であった体内にペースメーカーを留置している症例にも使用可能です。ただし、排泄されたカプセルを必ず回収しないと検査画像が読影できない点には注意が必要です。

新型小腸カプセルの回収、読影に必要な機材一覧
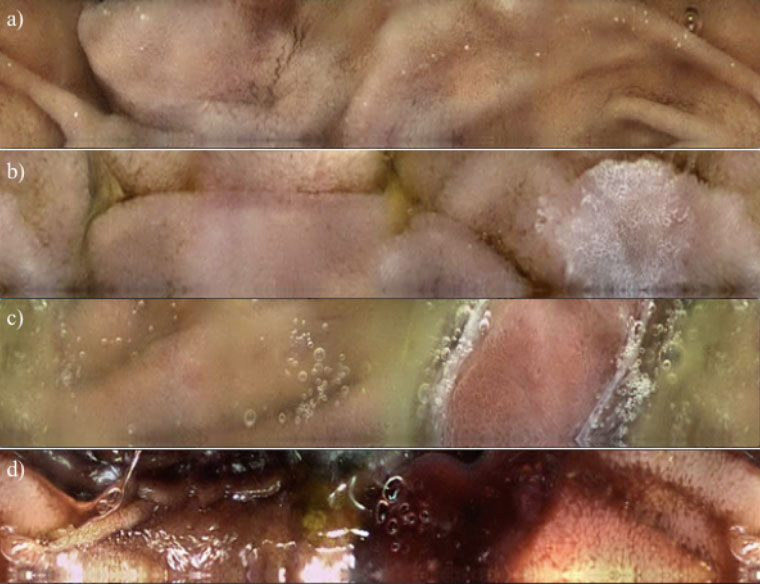
新型小腸で撮影された内視鏡画像。
a) GIST、 b) 家族性大腸腺腫症、c) Peutz-Jeghers症候群によるポリープ、d) 小腸出血
Virtual scaleを用いた生体内における大腸ポリープ径の計測
大腸ポリープはサイズによって治療適応や切除方法が決定されるため、サイズの推定は重要です。しかし、生体内の推定ポリープ径は術者の経験に基づくため、特に初学者ではサイズのばらつきが大きくなります。ワンタッチで画面上にバーチャルスケールが表示され、直接ポリープ径を計測可能な内視鏡が開発されています。これにより初学者でも正確にポリープ径の計測が可能となっています。
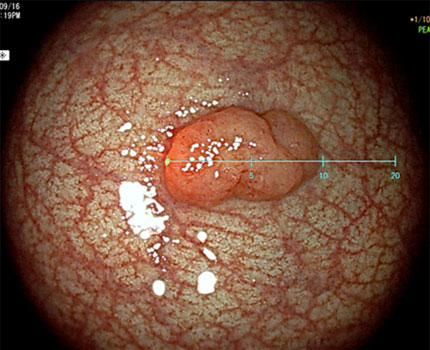
直線スケール

円形スケール
(図内の単位はmm)
特殊光観察を用いた大腸ESD
Red/Amber/Greenの特性の異なる3種類の光を用いて、血管・血液のコントラストを形成することにより、深部血管の視認性の向上、出血点の視認性の向上につながります。
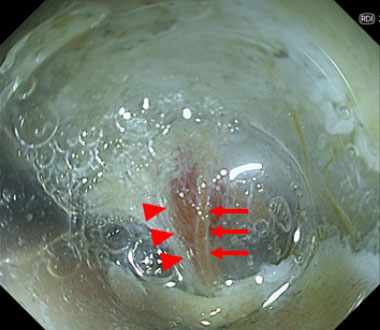
特殊光観察では、血中酸素化ヘモグロビン濃度の差により、動脈はオレンジ(→)、静脈は赤(▶︎)に視覚化されます。
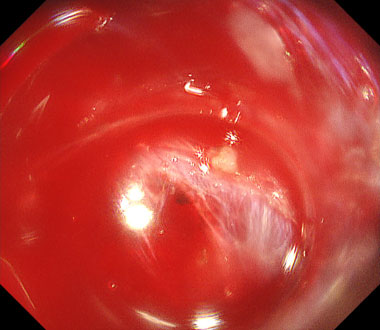
通常光観察では出血は一様に赤く見え、出血点の同定が困難なことが多いです。
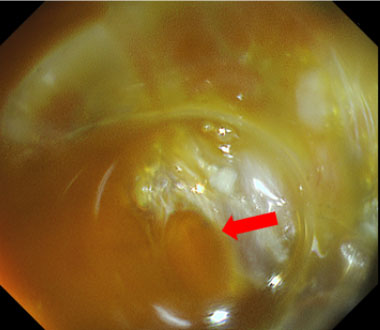
特殊光では出血点である高濃度血液部分は濃いオレンジ色、周囲に貯留した低濃度血液は淡い黄色となり、出血点が同定しやすくなります。
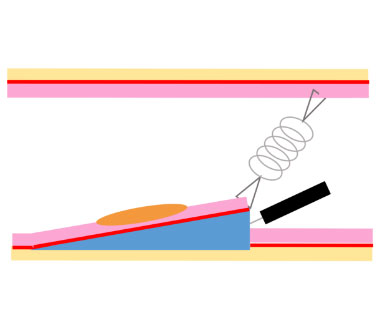
シングルバルーンスライディングチューブ
内視鏡スコープに先端バルーンのついたチューブを装着し、バルーンで腸管を固定することで、腸管のたわみや伸展を 防ぎ、スコープの動きがスムーズとなり、処置時の操作性が改善します。
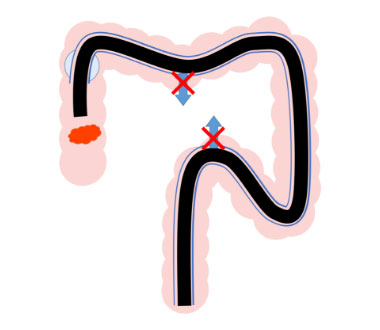
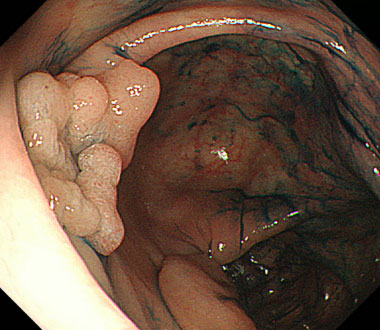
観察時、病変を画面の9時方向にみとめる。腸管がたわみ、内視鏡スコープを適切な位置に保持するのことが難し症例です。
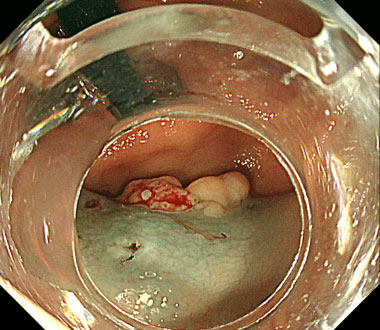
治療時、オーバーチューブを用いることで、スコープが安定し、内視鏡の反転操作も可能とな理ました。
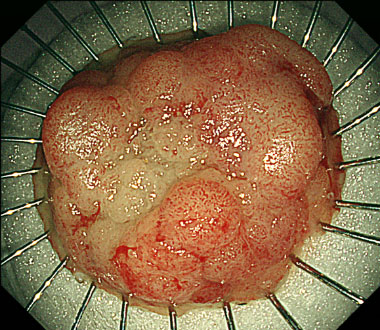
安全に病変を一括切除可能でした。
トラクションデバイス
病変をトラクションデバイスで持続的に牽引することで、剥離面の視野確保が容易になり、安全な内視鏡治療を行うことができるようになります。
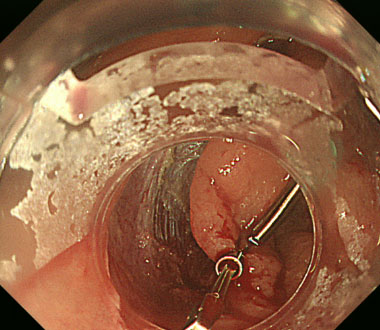
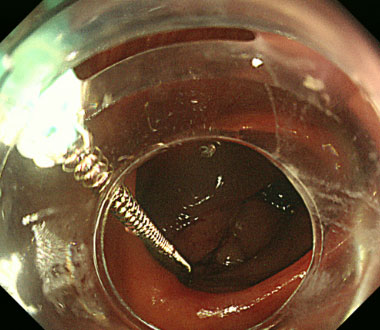
病変の辺縁にバネのついた牽引クリップをかけます。
バネの対側に通常のクリップをかけ、牽引して病変対側やや肛門側の粘膜壁に装着します。
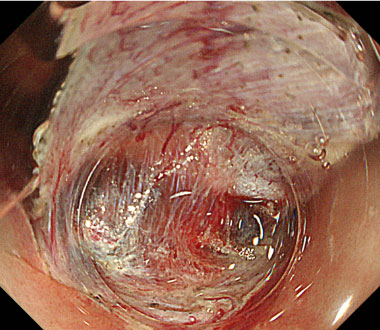
病変が牽引されて持ち上がり、剥離面の視野は良好となりました。
人工知能(Artificial Intelligence: AI)を用いた内視鏡診断
小腸カプセル内視鏡画像を用いたAI研究
小腸カプセル内視鏡の全撮影枚数は6万枚にも及ぶとされ、その読影には30分程度を要するため、読影医にとっては負担の大きい検査とされています。また、通常の内視鏡と比べ、無送気の状態かつ任意のタイミングで撮影されないため、病変が小さいと一部しか撮影されない場合もあり、見逃しに注意が必要です。我々は病変の見逃しリスクの低減、読影医の負担軽減を目的にカプセル内視鏡の画像を用いてディープラーニングで教育を行なったAIモデルを仙台厚生病院、東京大学、AIメディカルサービスと共同開発を行い、その有用性について報告してきました。今後臨床応用に向けてさらに研究をかさねていく予定です。
小腸カプセル内視鏡を用いたAIによる病変発見の実際
カプセル内視鏡画像を用いて教育したAIシステムを用いた内視鏡診断の実際。青色の矩形はAIが病変と認識した領域。
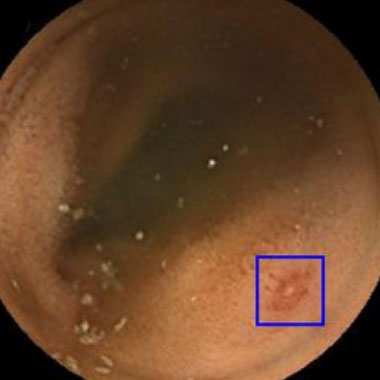
びらん
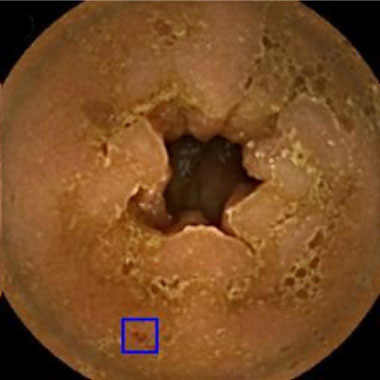
angioectasia
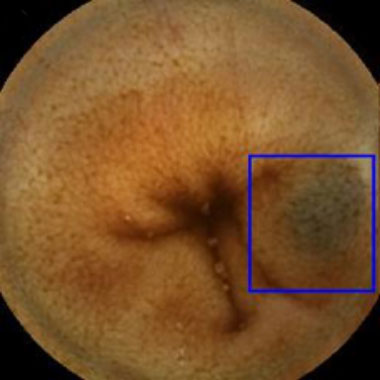
血管腫
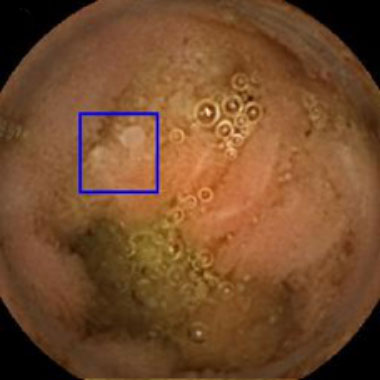
濾胞性リンパ腫
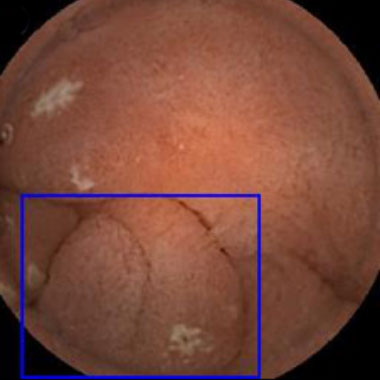
ポリープ
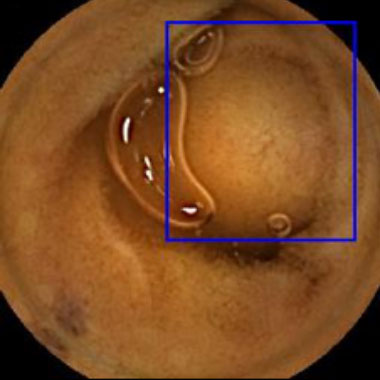
粘膜下腫瘍
大腸内視鏡画像を用いたAI研究
大腸腫瘍に対する狭帯域光拡大診断のためのJNET (The Japan NBI Expert Team) 分類は癌の診断や治療方針の決定に有用です。大腸内視鏡分野ではすでにAIを用いた内視鏡システムが臨床応用されていますが、JNET分類を用いたAIシステムは開発されていません。我々はAI診断支援を用いた大腸腫瘍の検出、JNET分類自動診断モデルを作成し、専門医の診断に近づけるよう研究しています。
大腸内視鏡を用いたAIによるJNET分類診断の実際
大腸腫瘍の内視鏡画像
専門医の診断 JNET Type 2A

AIが腫瘍を検出
病変範囲を決定
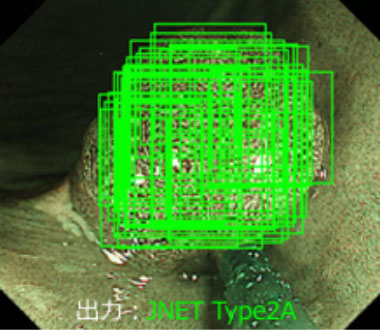
JNET分類を自動で診断
(専門医と一致)
腫瘍・癌
癌組織は癌細胞だけではなく、血管、平滑筋細胞、筋線維芽細胞、免疫担当細胞など様々な間質細胞と、それらを取り巻く豊富な細胞外基質から構成されています。我々はその中でも、筋線維芽細胞やマクロファージなどの間質を構成する細胞の腫瘍の発育進展・転移における役割に注目しています。生体における癌免疫微小環境を再現した同所移植マウスモデルを作成し、細胞生物学的アプローチから癌と間質の相互作用の解明、新規治療法の開発に取り組んでいます。
腫瘍微小環境

1. 癌と間質(CAF)の相互作用に着目した癌微小環境研究
腫瘍組織は癌細胞のみならず、各種免疫細胞を含む多様な間質細胞とともに形成されており、癌の発育と進展には、癌細胞と間質の相互作用が重要であることが明らかとなっています。我々はDesmoplastic reaction、間質反応の主役である癌関連線維芽細胞(carcinoma-associated fibroblast : CAF)の役割に着目し、CAFが腫瘍発育や治療に与える影響について研究しています。

実際に癌細胞を皮下移植したマウスからCAFを単離し、癌細胞と共培養や共移植を行うことで、in vitro, in vivoにおいて腫瘍微小環境を再現しています。この系を用いて、癌と間質の相互作用の解析やマウスモデルによる治療実験を行っています。
引用文献
- Kitadai Y, Sasaki T, Kuwai T, et al. Expression of activated platelet-derived growth factor receptor in stromal cells of human colon carcinomas is associated with metastatic potential. Int J Cancer. Dec 1 2006;119(11):2567-74.
- Shinagawa K, Kitadai Y, Tanaka M, et al. Mesenchymal stem cells enhance growth and metastasis of colon cancer. Int J Cancer. Nov 15 2010;127(10):2323-33.
- Takigawa H, Kitadai Y, Shinagawa K, et al. Mesenchymal Stem Cells Induce Epithelial to Mesenchymal Transition in Colon Cancer Cells through Direct Cell-to-Cell Contact. Neoplasia. May 2017;19(5):429-438.
2. 間質を標的とした消化管癌治療戦略
これまで消化管癌の腫瘍微小環境を再現した同所移植マウスモデルを使用し、間質を標的とした薬剤の抗腫瘍効果を検証してきました。

間質、特にCAFを標的とした薬剤と癌細胞を標的とした薬剤を併用することで、効果的に抗腫瘍効果が得られることを様々な薬剤で検証し、報告してきました。
引用文献
- Takigawa H, Kitadai Y, Shinagawa K, et al. Multikinase inhibitor regorafenib inhibits the growth and metastasis of colon cancer with abundant stroma. Cancer Sci. Feb 10 2016
- Sumida T, Kitadai Y, Shinagawa K, et al. Anti-stromal therapy with imatinib inhibits growth and metastasis of gastric carcinoma in an orthotopic nude mouse model. Int J Cancer. May 1 2011;128(9):2050-62.
- Onoyama M, Kitadai Y, Tanaka Y, et al. Combining molecular targeted drugs to inhibit both cancer cells and activated stromal cells in gastric cancer. Neoplasia. Dec 2013;15(12):1391-9.
- Yuge R, Kitadai Y, Shinagawa K, et al. mTOR and PDGF pathway blockade inhibits liver metastasis of colorectal cancer by modulating the tumor microenvironment. Am J Pathol. Feb 2015;185(2):399-408.
3. 癌免疫療法の有効性からみる免疫細胞浸潤機構の解明
近年、免疫チェックポイント阻害剤は、臨床試験において優れた成績が示され、適応拡大が進んでいます。しかし、大腸癌においてはその効果は限定的であることが知られており、免疫応答性に影響を与えるメカニズムの解明や、腫瘍免疫を強化する治療法の組み合わせは、がん業界全体にとって大きな関心事となっています。我々は、腫瘍免疫においてCAFが免疫細胞浸潤の障壁になっているのではないか?という仮説のもと、癌免疫療法に間質を標的とした治療を併用することで相乗効果が得られるかどうかを、マウスモデルを用いて検証しています。

治療実験で変化する腫瘍免疫微小環境を解析する際には、組織学的な解析に加え、RNAシークエンス解析、フローサイトメトリー解析を用いて、投与薬剤の治療効果を検証することにとどまらず、腫瘍微小環境における免疫細胞浸潤機構を解明することを目指しています。
引用文献
- Yorita N, Yuge R, Takigawa H, et al. Stromal reaction inhibitor and immune-checkpoint inhibitor combination therapy attenuates excluded-type colorectal cancer in a mouse model. Cancer Lett. Feb 1 2021;498:111-120.
- Kadota H, Yuge R, Shimizu D, et al. Anti-Programmed Cell Death-1 Antibody and Dasatinib Combination Therapy Exhibits Efficacy in Metastatic Colorectal Cancer Mouse Models. Cancers (Basel). Dec 13 2022;14(24)
4. 癌腫瘍間質とマクロファージの相互作用の解明
近年、腫瘍微小環境中におけるマクロファージの役割が盛んに議論されています。 マクロファージにはM1とM2の2つの分画が存在し、特にM2分画は腫瘍の進展に関与するとされ、腫瘍関連マクロファージ(Tumor Associated Macrophage:TAM)として注目を集めています。我々は、大腸癌の臨床検体におけるマクロファージの局在や極性変化が、腫瘍の特性にどのような影響を与えているのかを解析するとともに、腫瘍微小環境の重要な構成要素であるCAFとの相互作用の解明を目指し研究を行っています。

分子生物学的にマクロファージと腫瘍間質が腫瘍進展に及ぼす影響を評価するとともに、マクロファージの阻害薬や腫瘍間質を阻害する薬剤のシナジーを評価することで、新規の大腸癌治療コンセプトの提案を目指したトランスレーショナルリサーチを行っています。
引用文献
- Inagaki K, Kunisho S, Takigawa H, et al. Role of tumor-associated macrophages at the invasive front in human colorectal cancer progression. Cancer Sci. Jul 2021;112(7):2692-2704.
- Shimizu D, Yuge R, Kitadai Y, et al. Pexidartinib and Immune Checkpoint Inhibitors Combine to Activate Tumor Immunity in a Murine Colorectal Cancer Model by Depleting M2 Macrophages Differentiated by Cancer-Associated Fibroblasts. Int J Mol Sci. Jun 26 2024;25(13)
5. 癌に対するStarving therapyの有効性
多様な分子標的薬が開発され、その有用性が検証されている中で、近年では腫瘍の栄養取り込みを阻害することで癌細胞を飢餓状態に至らしめ、抗腫瘍効果を発揮するユニークな機序を持つ薬剤が新規に開発されてきています。
私たちは、必須アミノ酸の取り込み阻害による抗腫瘍効果を示すとともに、その際に代償性に活性化する非必須アミノ酸の代謝に作用する薬剤の薬効を評価するなど、多方面から癌細胞の飢餓誘導に関する研究を行っています。また、がん細胞の栄養供給を遮断しつつ、正常な組織への影響を最小限に抑えながら抗腫瘍効果を維持するための工夫にも取り組んでいます。
これらの薬剤が腫瘍微小環境に与える影響にも着目し、網羅的な遺伝子発現プロファイル解析や分子生物学的解析を行い、その作用機序と,より安全性の高い治療法の確立を目指しています。

公共データベース解析、in vitro実験、動物実験、臨床検体の解析を組み合わせた多面的な解析フローを得意としており、系統的な薬効解析を行っています。
引用文献
- Otani R, Takigawa H, Yuge R, et al. The Anti-Tumor Effect of the Newly Developed LAT1 Inhibitor JPH203 in Colorectal Carcinoma, According to a Comprehensive Analysis. Cancers (Basel). Feb 22 2023;15(5)
- Miyamoto R, Takigawa H, Yuge R, et al. Analysis of anti-tumor effect and mechanism of GLS1 inhibitor CB-839 in colorectal cancer using a stroma-abundant tumor model. Exp Mol Pathol. Jun 2024;137:104896.
NHPH感染症とリンパ増殖性疾患
悪性リンパ腫とは血液がん(造血器腫瘍)の1つで、白血球の一種であるのリンパ球ががん化した疾患です。
胃MALTリンパ腫の病因として、Helicobacter pylori (HP)感染症、 BIRC3::MALT1融合遺伝子が知られていますが、近年、Non-Helicobacter Pylori Helicobactes(NHPH)というHPの類縁菌種の感染によって胃MALTリンパ腫が生じることが明らかになってきています。
消化管での発生頻度が高く、除菌治療などの低侵襲治療が奏功するとされる胃MALTリンパ腫に関して、私たちはNHPHに着目し研究を行っており、その一部ご紹介します。
1. 胃MALTリンパ腫の病因の変化 -H. pylori感染症の減少-
胃MALTリンパ腫の病因として、HP感染症、BIRC3::MALT1融合遺伝子が以前から知られています。近年、インフラ整備により衛生環境が改善し、HP感染症は減少傾向にあり、それに伴って胃MALTリンパ腫の病因も変化してきました。 HP感染の減少に伴い、HP陰性胃MALTリンパ腫が経年的に増加しており、私たちはその病態解明に取り組んでいます。
胃MALTリンパ腫症例におけるHP感染率の年次推移

2. BIRC3::MALT1融合遺伝子とH. pylori感染状況別の胃MALTリンパ腫治療成績
BIRC3::MALT1融合遺伝子が存在する胃MALTリンパ腫では、除菌治療が無効なことが多いとされています。一方、この融合遺伝子が存在しない場合に、HP感染症に対する除菌治療(抗生物質治療)を行うことで治癒が期待できることが以前から知られており、低侵襲な治療として広く用いられてきました。
近年、HP感染症が存在しない症例においても、一定数HP感染症に対する除菌治療が奏功することが分かり、HPが存在しないにも関わらず抗生物質治療が有効となる理由に関心が高まっていきています。
API2-MALT1遺伝子, H. pylori感染状況別の除菌療法効果

引用文献
- Takigawa H, Yuge R, Masaki S, et al. Involvement of non-Helicobacter pylori helicobacter infections in Helicobacter pylori-negative gastric MALT lymphoma pathogenesis and efficacy of eradication therapy. Gastric Cancer. Jul 2021;24(4):937-945.
3. H. pylori陰性胃MALTリンパ腫における除菌治療奏功因子
HP陰性胃MALTリンパ腫の病態を解明するための試みの1つとして、私たちは除菌治療による寛解の可否を予測するpredictive markerとなる遺伝子の検索を目的に、網羅的な遺伝子プロファイル解析を行いました。
HP陰性にも関わらず除菌治療が奏功する症例には、何らかの遺伝子発現の特徴が存在するのではないかと考え解析を進めました。
その結果、除菌治療奏功例では、感染関連pathway上の遺伝子群の発現が高く、一方で除菌治療が無効な症例では、癌関連のpathway上の遺伝子群の発現が大きく上昇していることを見出しました。さらに、予測因子となる遺伝子(NANOG、OLFM4)を同定しました。

引用文献
- Takigawa H, Yuge R, Miyamoto R, et al. Comprehensive Analysis of Gene Expression Profiling to Explore Predictive Markers for Eradication Therapy Efficacy against Helicobacter pylori-Negative Gastric MALT Lymphoma. Cancers (Basel). Feb 14 2023;15(4).
4. 胃癌とNon-Helicobacter Pylori Helicobacter(NHPH)感染症の関連性
Non-Helicobacter Pylori Helicobacter(NHPH)と総称されるHPの類縁菌種の存在が近年注目を集め、炎症に起因する様々な胃疾患を生じさせることが報告されるようになってきましたが、各種の胃疾患の発症にどの程度寄与しているのかなどの詳細は解明されていません。私たちはこのNHPHと胃の悪性腫瘍との関係に焦点を当てて、研究を行っています。
NHPHは、胃の粘膜上皮にもある程度の炎症を生じさせますが、その作用はHPと比べると弱いとされています。そのため通常の胃癌の発癌への影響は少ないのではないかと私たちは考え検証を行いました。胃癌症例と、非胃癌症例でのNHPH感染率を比較すると、ほぼ同様のNHPH感染率であり、NHPHが胃癌の発癌に寄与している可能性が低いことを見出しました。
胃癌の有無別でのNHPH感染率の比較

さらにNHPH感染が背景にある胃癌と、NHPH非感染の胃癌の臨床病理学的特徴を比べましたが、NHPH感染によって、血清胃炎マーカーや、胃癌の特性にほとんど影響を与えないことがわかってきました。
NHPH感染胃癌と、NHPH非感染胃癌の臨床病理学的特性比較

引用文献
- Abuduwaili M, Takigawa H, Yuge R, et al. No significant association between non-Helicobacter pylori Helicobacter infection with gastritis-related indices and gastric cancer. Am J Med Sci. Dec 2023;366(6):421-429.
5. 胃MALTリンパ腫症例でのNon-Helicobacter Pylori Helicobacter(NHPH)感染状況
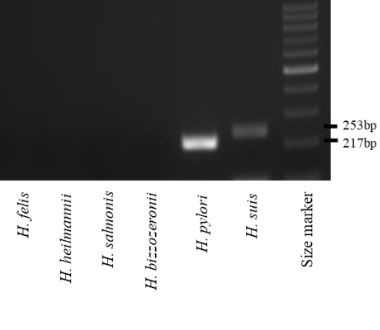
一方で、このNHPHは胃MALTリンパ腫の発症に強く関与していることが推察されてきました。私たちは、胃MALTリンパ腫の中で、HP感染や遺伝子異常などの他の病因が存在しない症例の中に、一定の割合でNHPH感染が存在するのではないかと考え、感染状況を解析いたしました。
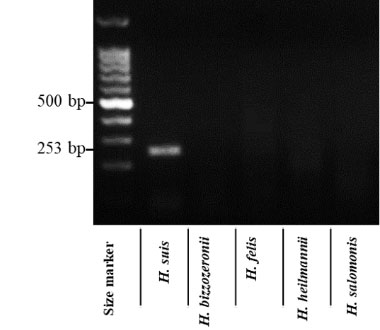
臨床的にNHPH感染の診断法は確立しておらず、従来は組織学的診断がゴールドスタンダードとされていましたが、近年ではPCRによる診断が可能となっており、臨床研究が盛んとなってきています。私たちのグループでは、パラフィン固定標本からDNAを抽出し、PCR法により、NHPHの感染の有無を診断致しました。
PCR法によるNHPH感染診断

引用文献
- Takigawa H, Yuge R, Masaki S, et al. Involvement of non-Helicobacter pylori helicobacter infections in Helicobacter pylori-negative gastric MALT lymphoma pathogenesis and efficacy of eradication therapy. Gastric Cancer. Jul 2021;24(4):937-945.
- Masaki S, Takigawa H, Kunisho S, et al. Association between Helicobacter suis infection and the pathogenesis of gastric mucosa-associated lymphoid tissue lymphoma. Origina article. Hiroshima Journal of Medical Sciences. 2020;69(2):33-37.
6. H. pylori陰性胃MALTリンパ腫でのNHPH感染状況と除菌治療奏功性との関わり
HP陰性胃MALTリンパ腫29例を対象にNHPHの感染状況を調べると、約半数(55%)にNHPH感染を認め、比較的高率にNHPH感染が存在する事が明らかとなりました。さらに、NHPH陽性例では除菌治療に対する良好な治療反応が得られる事が分かりました。
HP陰性胃MALTリンパ腫のNHPH感染状況と除菌治療の奏効率

HP感染状況やBIRC3::MALT1融合遺伝子に加えてNHPH感染状況も考慮することで、除菌治療の奏功性の予測や治療方針の決定に寄与しうる事を示唆し、NHPH感染診断の重要性とその意義を提唱しています。
NHPHを考慮した胃MALTリンパ腫治療アルゴリズム案

引用文献
- Takigawa H, Yuge R, Masaki S, et al. Involvement of non-Helicobacter pylori helicobacter infections in Helicobacter pylori-negative gastric MALT lymphoma pathogenesis and efficacy of eradication therapy. Gastric Cancer. Jul 2021;24(4):937-945.
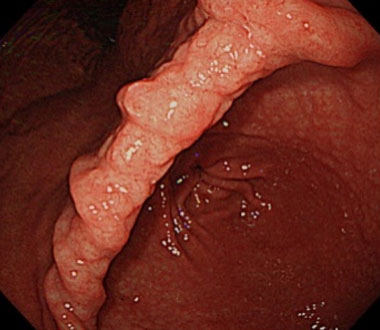
7. NHPH陽性胃MALTリンパ腫の内視鏡的特徴
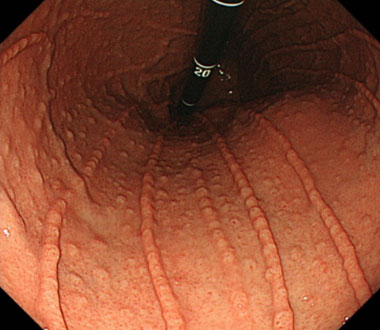
NHPH感染によって惹起される胃MALTリンパ腫において、鳥肌胃炎様や、multiple lymphomatous polyposis (MLP)様の特徴的な内視鏡像を呈することを報告してきました。
鳥肌胃炎様の形態を呈するNHPH感染性胃MALTリンパ腫
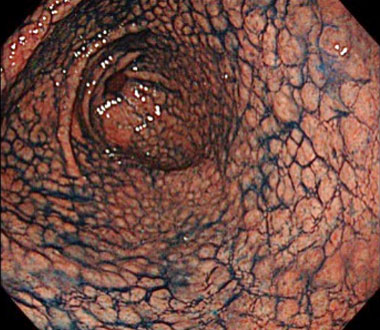
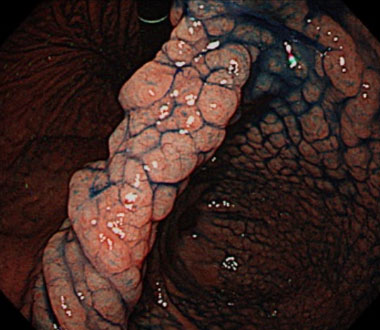
MLP様の形態を呈するNHPH感染性胃MALTリンパ腫
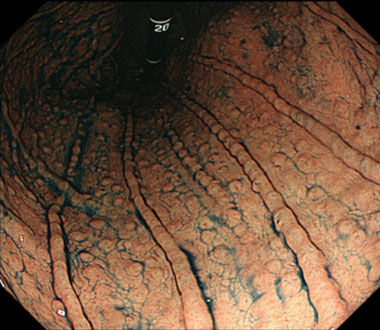
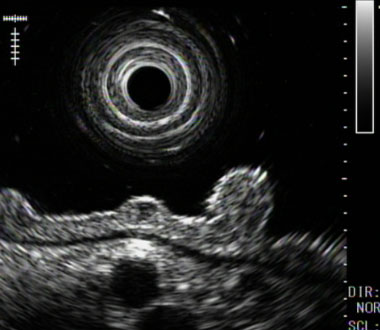
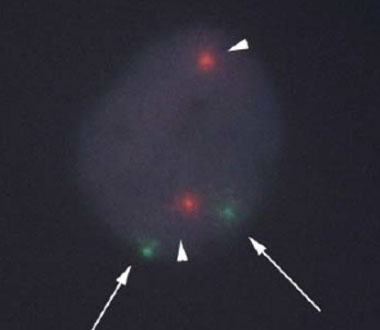
また、NHPH感染症によって惹起される胃背景粘膜の特徴を明らかにし、これらの内視鏡像が観察される症例においては、Hpに対する除菌療法によって、NHPH感染が消退し、胃MALTリンパ腫の寛解が得られることが分かりました。
NHPH感染によって惹起される背景粘膜の特徴

引用文献
- Takigawa H, Masaki S, Naito T, et al. Helicobacter suis infection is associated with nodular gastritis-like appearance of gastric mucosa-associated lymphoid tissue lymphoma. Cancer Med. Aug 2019;8(9):4370-4379.
- Naito T, Yuge R, Tanaka S, et al. Gastric mucosa-associated lymphoid tissue lymphoma in conjunction with multiple lymphomatous polyposis in the context of Helicobacter pylori and Helicobacter suis superinfection. Clin J Gastroenterol. Apr 2021;14(2):478-483.
- Kadota H, Yuge R, Miyamoto R, et al. Investigation of endoscopic findings in nine cases of Helicobacter suis-infected gastritis complicated by gastric mucosa-associated lymphoid tissue lymphoma. Helicobacter. Apr 1 2022:e12887.
8. NHPH感染鳥肌胃粘膜様胃MALTリンパ腫とHP感染鳥肌胃炎の内視鏡的特徴の比較
また、HP感染とNHPH感染によって生じる内視鏡所見の違いに着目した研究も行っています。両者は類似した内視鏡所見を呈することが多いものの、詳細にみていくとわずかな違いがみられ、両者の鑑別が臨床的に重要視されるようになってきました。
例えば、鳥肌胃炎という胃の粘膜に結節が多発する特徴的な内視鏡像は従来、HP感染により惹起される病態として知られいましたが、我々の研究により、NHPH感染によっても類似した鳥肌様胃粘膜を呈する胃MALTリンパ腫が存在すことが明らかになってきました。
そこで、私たちは、両者の内視鏡的鑑別を目的として、それぞれの病態における内視鏡像の相違点に着目し、比較解析を行いました。
内視鏡的特徴を定性的・定量的に比較

結節の大きさ、形態、分布、狭帯域光(NBI)による拡大観察などの内視鏡的特徴により、両者を高精度に鑑別可能であることが明らかとなりました。
引用文献
- Kitadai Y, Takigawa H, Oka S, et al. Endoscopic features differentiating non-Helicobacter pylori Helicobacter-induced gastric mucosa-associated lymphoid tissue lymphoma with a nodular gastritis-like appearance and H. pylori-induced conventional nodular gastritis. Dig Endosc. May 2025.
炎症性腸疾患
我々は炎症性腸疾患(Inflammatory Bowel Disease; IBD)に対する研究を臨床、基礎の両面から行っています。
IBD診療でのバイオマーカーの活用
IBD診療では、症状が消失した臨床的寛解と内視鏡的に炎症が認められない内視鏡的寛解が治療目標として挙げられます。しかし、この2つの寛解は同時に得られるとは限らず、臨床的寛解になっても内視鏡的寛解には至っていないケースがしばしば経験されます。内視鏡的寛解は各種内視鏡検査で確認する必要がありますが、内視鏡検査はある程度の負担があるため頻回に行うことができません。その為、内視鏡検査の代替となるバイオマーカーが用いられます。
一般的に使用されるバイオマーカーとして、血清CRP、血清LRG、便中カルプロテクチン、便潜血定量が挙げられますが、我々はこれらに加え血清アミロイドA(SAA)に着目して診療、研究を行っています。
内視鏡的活動性あり
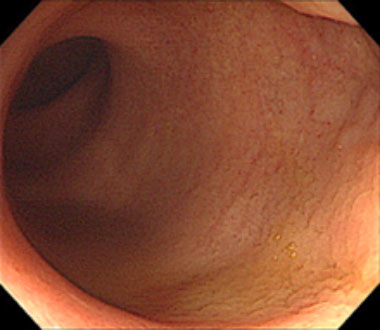
内視鏡的寛解
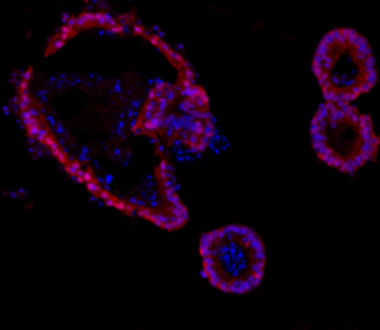
体外腸管上皮培養細胞(マウス)におけるToll様受容体刺激によるSAAの発現
引用文献
- Wakai M, Hayashi R, Tanaka S, Naito T, Kumada J, Nomura M, Takigawa H, Oka S, Ueno Y, Ito M, Chayama K:Serum amyloid A is a better predictive biomarker of mucosal healing than C-reactive protein in ulcerative colitis in clinical remission. BMC Gastroenterol. 20. 2020
- Wakai M, Hayashi R, Ueno Y, Onishi K, Takasago T, Uchida T, Takigawa H, Yuge R, Urabe Y, Oka S, Kitadai Y, Tanaka S:Promoting mechanism of serum amyloid a family expression in mouse intestinal epithelial cells. PLoS One. 17. 2021
IBDにおける腸管外合併症
IBDでは、主病変である腸管以外の臓器にも免疫機構異常が関与していると考えられる症状が出現することが知られています。有名なものとしては、皮膚病変、関節病変、眼病変が挙げられます。
我々は、これまであまり注目されていなかった腎病変について、IBDセンター運営でも連携している腎臓内科とともに実態調査を行っています。
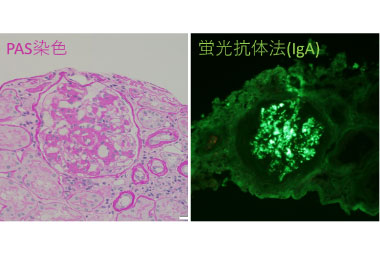
IgA腎症の顕微鏡画像
(腎臓内科 正木崇生教授、佐々木健介先生よりご提供)
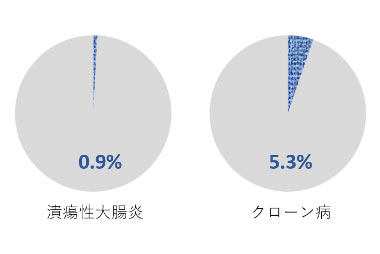
IgA腎症併存率
(疑診例を含む)
引用文献
- Hayashi R, Ueno Y, Tanaka S, Onishi K, Takasago T, Wakai M, Naito T, Sasaki K, Doi S, Masaki T, Chayama K:Clinical characteristics of inflammatory bowel disease patients with immunoglobulin A nephropathy. Intest Res. 19. 2021
潰瘍性大腸炎 (UC) に発生する腫瘍の研究
UC患者には長年の腸管炎症が原因となり発生するUC関連腫瘍 (UC associated neoplasia; UCAN) だけでなく、炎症に関与しない通常型の腫瘍 (Sporadic neoplasia; SN) も発生します。 しかし、UC患者に発生するSNのみに焦点を絞った研究はほとんどありません。 そこで当科で切除されたSNの臨床病理学的特徴と予後について検討しました。 初回SN治療時に複数病変を認めた場合には、その後の異時性病変の発生率が高いことがわかりました。
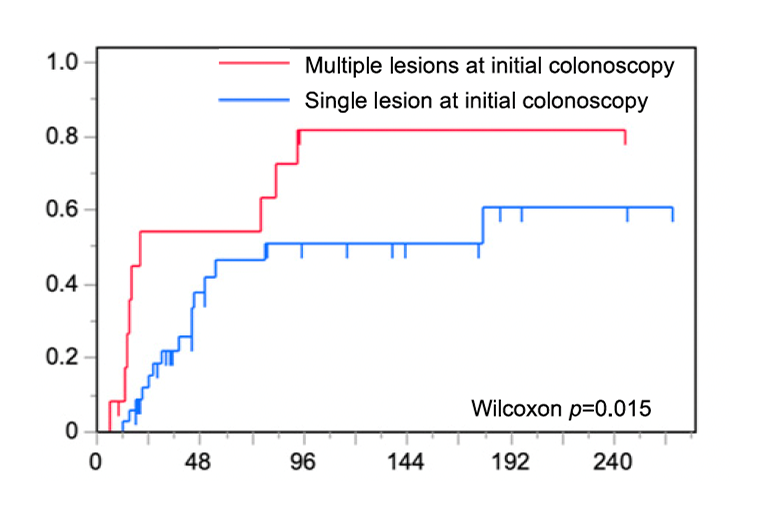
引用文献
- Yamamoto N, et al. Characteristics and Prognosis of Sporadic Neoplasias Detected in Patients with Ulcerative Colitis, 2024; 105(3): 213-223.
IBD領域での基礎研究
IBDの治療薬は次々に開発されており、使用できる薬剤が増えてきました。しかし、ほとんどの薬剤は免疫抑制作用によりIBDの炎症を改善させるものであり、その薬理作用が癌に与える影響が注目されています。我々は、大腸癌細胞株のマウス同所移植モデルを用いて、薬剤が癌細胞や癌微小環境に与える影響について研究しています。
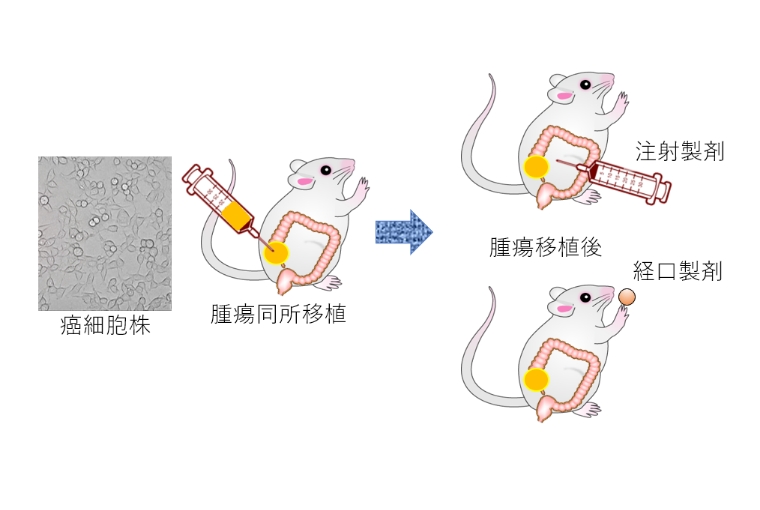
がんゲノム解析
近年、シークエンスやアレイ技術の進歩により全ゲノム網羅的な解析が可能となり、様々な疾患で原因遺伝子が特定されている。がんのDriver mutationについてもこのような解析において、各種がんで同定されており、癌関連遺伝子をシークエンスすることで、適切な抗癌剤の使用や抗癌剤耐性の指標として利用するがんゲノム医療が保険適応となっています。我々は内視鏡で切除した検体を用いることによってがん発生の早期段階での遺伝子異常が組織型やがん浸潤に与える影響について調べています。またこのような研究を通じて、がんが「どのようにして浸潤するのか」や 「どのようにして転移するのか」について調べています。
ヘリコバクター・ピロリ除菌後に癌表層に発生する低異型度な上皮の由来を明らかにする研究
ヘリコバクター・ピロリ菌除菌後、胃癌の表層に正常粘膜上皮に近い低異型度の上皮 (epithelium with low grade atypia: ELA, a) 【1】 が知られていますが,この上皮がどのように発生するのか(癌の一部が変化したのか、正常粘膜が癌表層を被覆したのか)はわかっていませんでした。このため我々は、次世代シークエンサーを用いた癌遺伝子パネル検査を行うことによってELAが癌由来であることを証明しました。【2】
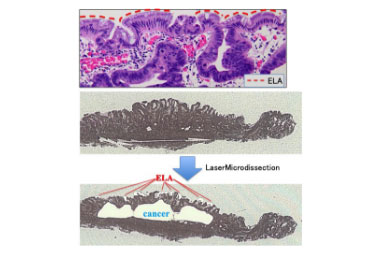
癌表層にあるELAを選択的にレーザーマイクロダイセクションにて抽出しました

正常粘膜、癌部、ELA部でのゲノム変異について解析し対比しています。
引用文献
- 【1】Ito M, et al. Pharmacol Ther 2005, Kitamura Y, et al. Helicobacter. 2014
- 【2】Masuda K, Urabe Y, Ito M, et al. J Gastroenterol. 2019; 54:907-915.
癌ゲノムシークエンスを用いた胃癌の発生原因を明らかにする研究
ヘリコバクター・ピロリ菌 (Hp) から発生する毒素CagAが胃癌の発生に関与することが知られていますが、この毒素はHpから発生される別の毒素VacAを用いたオートファジー機構を用いて短時間で分解されるとされています。このためCagAがどのように胃癌の発生に関与しているか明らかではありませんでした。我々は早期胃癌のがんゲノム解析を行うことによって、LRP1という遺伝子に変異が起こることによって、CagAのオートファジーが阻害され、CagAが長期間存在することによってがん化する可能性を報告しました。
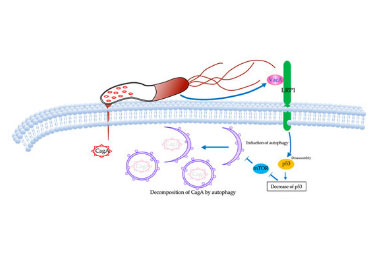
HPから出る発癌性毒素CagAはBacAの取り込みによってLRP1受容体が活性化し、CagAのオートファジーを惹起する。
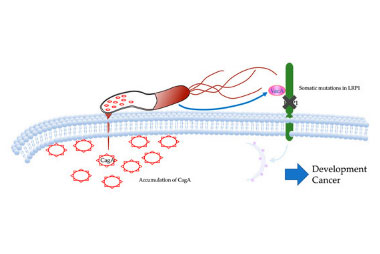
LRP1変異によるオートファジー機構が破綻し、細胞内にCagAが蓄積する。
引用文献
- Nakamura K, Urabe Y, Kagemoto K, et al. Cancers (Basel). 2020; 12: 510.
潰瘍性大腸炎由来である大腸腫瘍のゲノム変異に基づく発生誘因の鑑別
潰瘍性大腸炎 (UC) 患者の大腸から発生する腫瘍は、UCの炎症が原因で発生する腫瘍と通常の大腸腫瘍と同じような経路で発生する腫瘍に大きく分けられますが、これらを鑑別するのは病理組織所見でも困難なことが多いです。我々はがんゲノム解析を用いて簡便に鑑別する方法を同定しました。
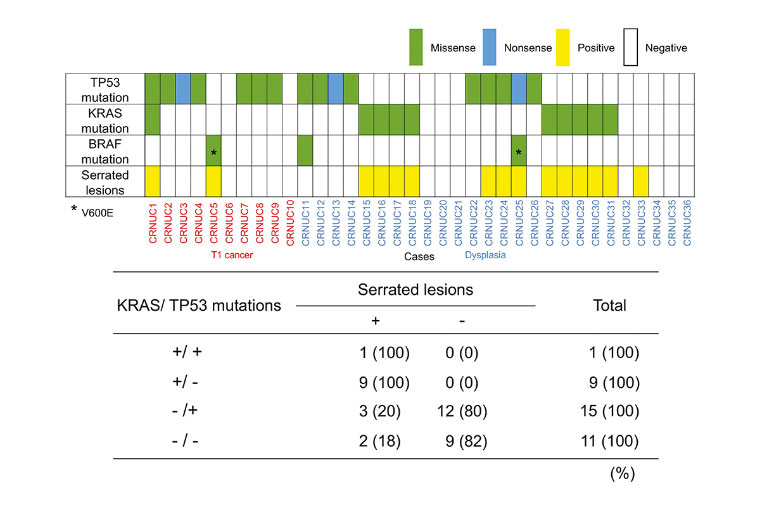
さらにこの鑑別方法が生検検体でも有用であることを証明しました。

引用文献
- Matsumoto K, Urabe Y, Oka S, et al. Inflamm Bowel Dis. 2021; 27: 686-696
- Yamamoto N, Urabe Y, Nakahara H et al. Cancers (Basel). 2024; 16: 3271.
Post-colonoscopy colorectal cancerのゲノム異常解析
大腸癌の患者のサーベイランスでは、大腸内視鏡で大腸腫瘍で異時性腫瘍を認めることが重要ですが、実際にはきちんとサーベイランスをしていても癌 (PCCRC) が発見されることがあります。ほとんどのPCCRCは大腸のひだ裏などにある見落とし癌ですが、中には急速に大きくなったとしか思えない癌 (急速進行癌) も認めます。我々はゲノム解析にて急速進行癌は、BRAFという遺伝子に変異のある、ミスマッチ修復遺伝子異常がある癌かPIK3CAという遺伝子に変異がある癌であることを同定しました。
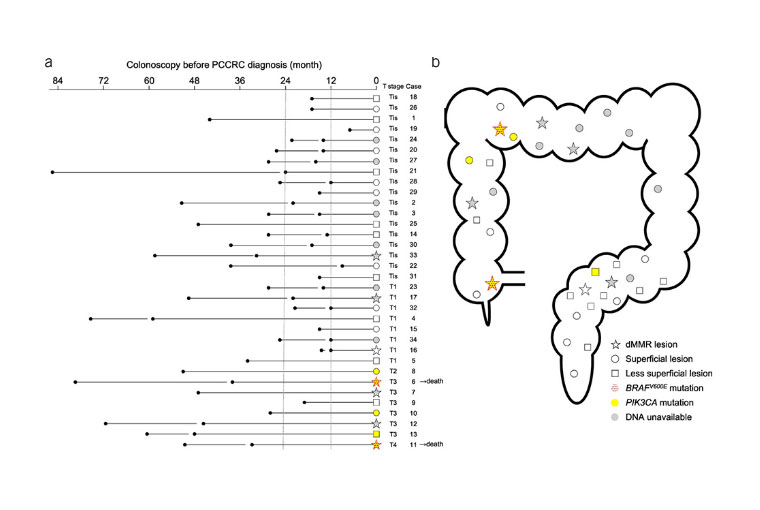
引用文献
- Tanaka H, Urabe Y, Oka S, et al. Clin Transl Gastroenterol. 2020; 11: e00246.
小腸がんのゲノム異常解析
希少がんとして知られる小腸がんのゲノム解析をして、予後に遺伝子変異量 (TMB) とSMAD4という遺伝子変異が関連あることを報告しています。
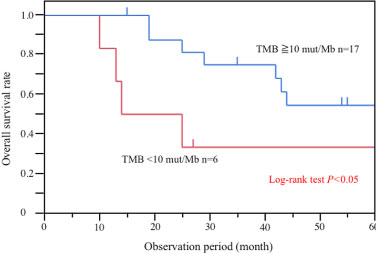
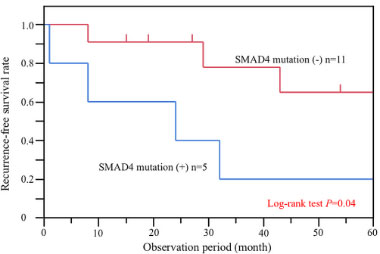
引用文献
- Tsuboi A, Urabe Y, Oka S et al. PLoS One. 2021; 16: e0241454
食道癌内視鏡治療後の異時性多発にはアルコール代謝に関連するSNPと飲酒・喫煙歴などが関与する
食道癌の発生にはアセトアルデヒドと言われる発癌性物質が関与することが知られており、これはお酒の分解の過程で発生したり、タバコに含まれていたりします。このアルコール代謝の分解に関わる遺伝子の違いによって食道癌が発生しやすい人がいることが知られています。我々はこの遺伝子の違いが早期段階の食道癌の多発にも関連することを報告しました。
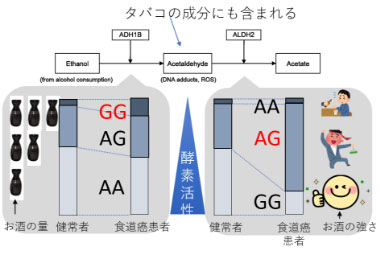
さらに食道癌の発症に強い関連を示す飲酒歴や喫煙歴がない方でも食道癌が発生することがありますが、その原因について臨床病理学的・遺伝学的に明らかにして報告しました。

引用文献
- Kagemoto K, Urabe Y, Miwata T, et al. Cancer Med. 2016; 5: 1397-404.
- Urabe Y, Kagemoto K, Nakamura K, et al. Esophagus. 2019; 16: 141-146.
- Fukuhara M, Urabe Y, Nakahara H, et al. Cancer Med. 2024; 13: e7078.
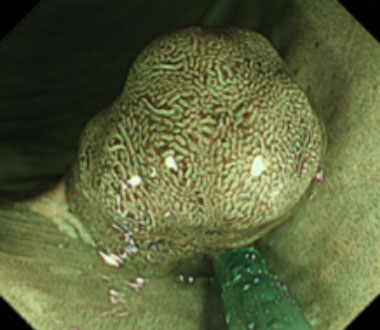
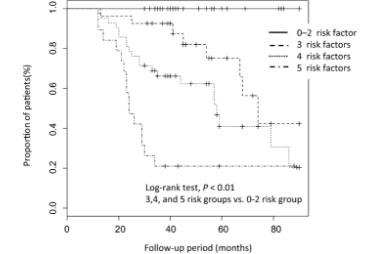
serrated polyposis syndrome(SPS)
SPSは、大腸内に鋸歯状病変が多発する大腸ポリポーシスで、大腸癌の合併頻度が高い症候群です。診断基準は1. 少なくとも直腸より近位に5mm以上の鋸歯状病変が5個以上、そのうち少なくとも2個以上が径10 mm以上の大きさを持つ腫瘍を有している。2. 大きさは問わないが、全大腸に鋸歯状病変を20個以上有し、5個以上が直腸より近位に存在する。このうち1つ以上の基準を満たせばSPSとして診断されます。
SPS 例 (37歳女性)
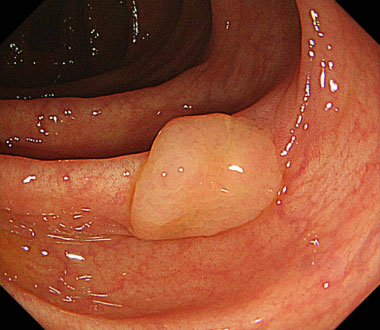
通常観察像。上行結腸に約10mm大の0-IIa病変を認めます。
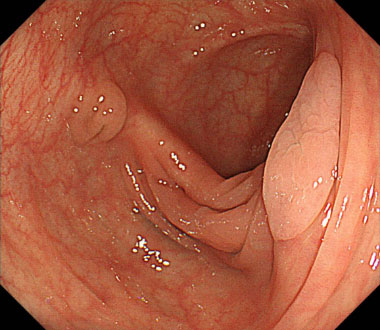
通常観察像。肝弯曲部に約20mm大の0-IIa、その対側に約5mm大の0-IIaを認めます。
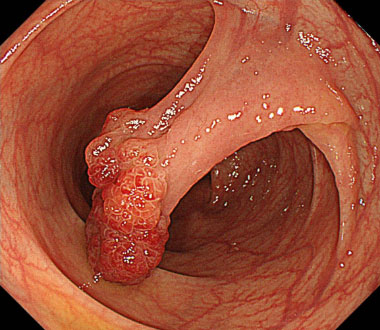
通常観察像。下行結腸に約20mm大の0-Ip型病変を認めます。
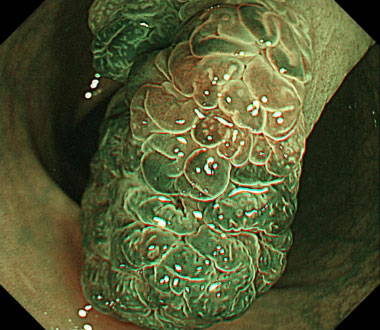
狭帯光域拡大観察像。頂部はJNET Type 2Aでした。
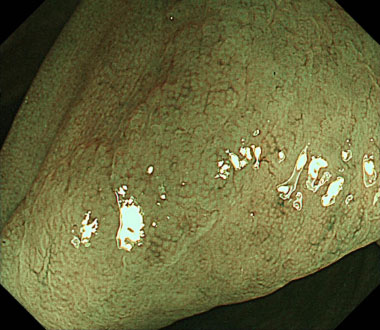
狭帯光域拡大観察像。茎部はJNET Type 1でした。
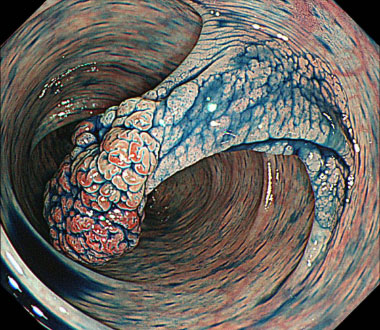
色素観察像(インジコカルミン散布)。
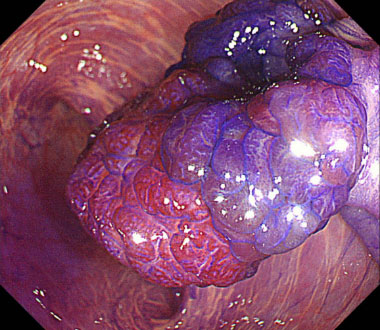
色素拡大観察像(クリスタルバイオレット染色)。頂部はIV型pit patternでした。
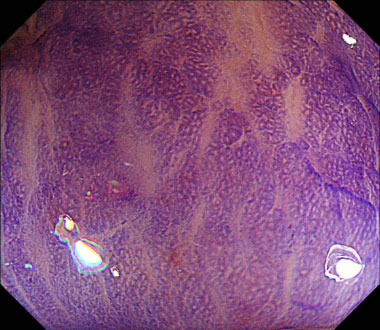
色素拡大観察像(クリスタルバイオレット染色)。茎部はII型pit patternでした。
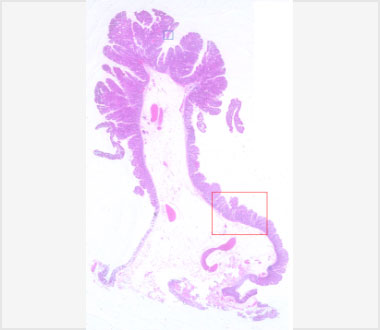
切除標本のルーペ像。
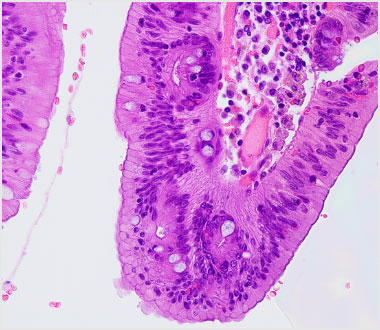
病理組織強拡大像(HE染色)。頂部の上皮には大型、類円形の腺管からなる腫瘍細胞を認めました。
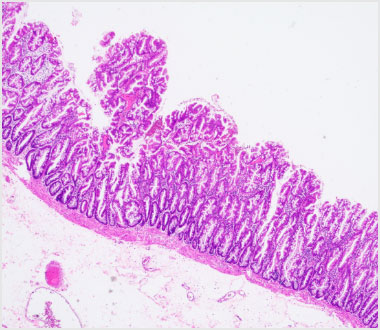
病理組織弱拡大像(HE染色)。茎部の細胞は鋸歯状に配列していました。
現在、岡 志郎教授が部会長となり遺伝性腫瘍学会でSPS部会が立ち上がっています。



