研究
研究
肝癌患者の長期予後改善を目指した集学的治療の取り組み
肝癌の治療法は、肝切除、ラジオ波・マイクロ波焼灼療法、カテーテル療法(肝動脈化学塞栓療法、肝動注化学療法)、薬物療法、放射線療法、肝移植など、極めて多岐にわたっております。また、肝癌の長期成績向上においては、ウイルス性肝炎や肝硬変などの背景となる肝疾患に対する緻密な治療を行うことも極めて重要です。当科では、長期的な視野に立って、最善の治療を選択するために、あらゆる治療選択肢を呈示させていただき、内科、外科、放射線科との緊密な連携のもと、肝癌に対する先進的で集学的な治療を実践しています。さらに、肝癌に対する新規治療法の開発を目指した多くの多施設共同臨床試験や治験にも参加しています。
1st lineレンバチニブと2nd lineアテゾリズマブ/ベバシズマブ不応例に対するレンバチニブ re-charenge
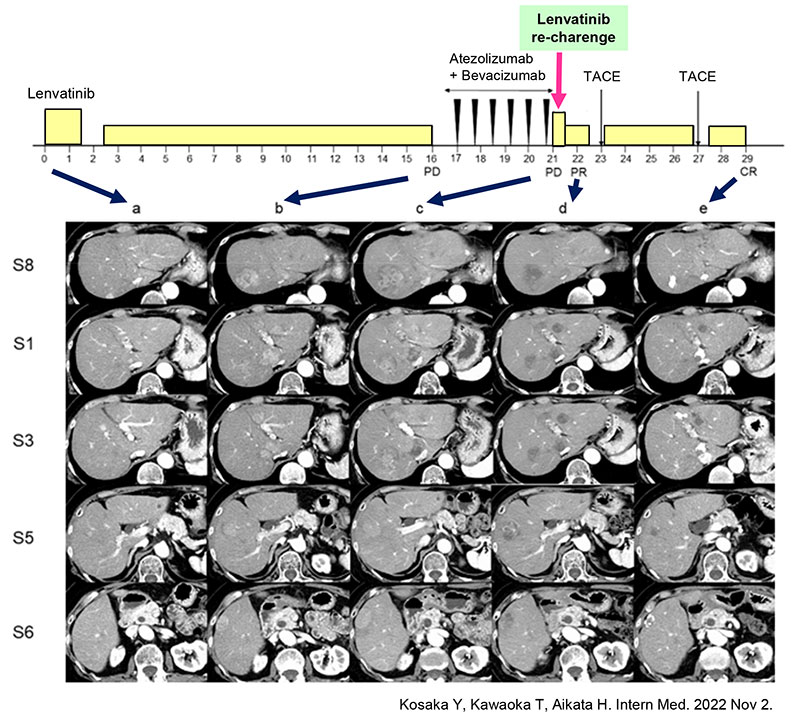
本論文では、1st lineのレンバチニブ(LEN)と2nd lineのアテゾリズマブ/ベバシズマブ不応例に対して、LEN re-charengeとそれに続くTACE(肝動脈化学塞栓療法)で完全奏効を得られた進行肝細胞癌症例について報告をしました。
切除不能肝細胞癌患者に対するアテゾリズマブ+ベバシズマブ治療の早期腫瘍効果と安全性
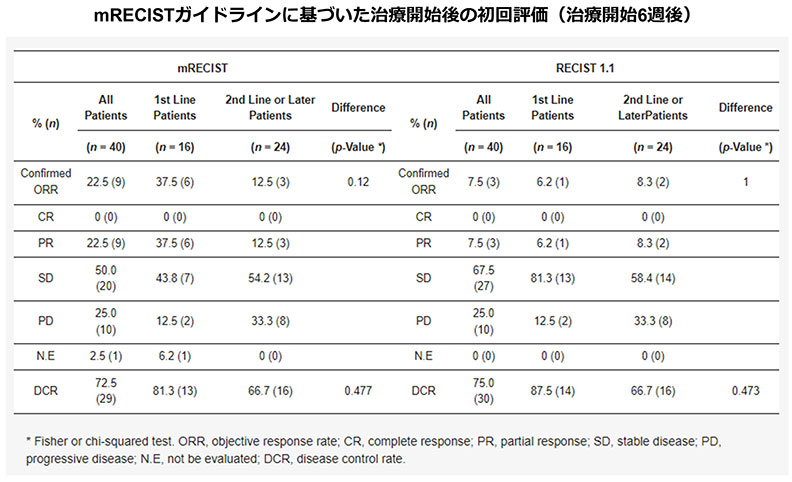
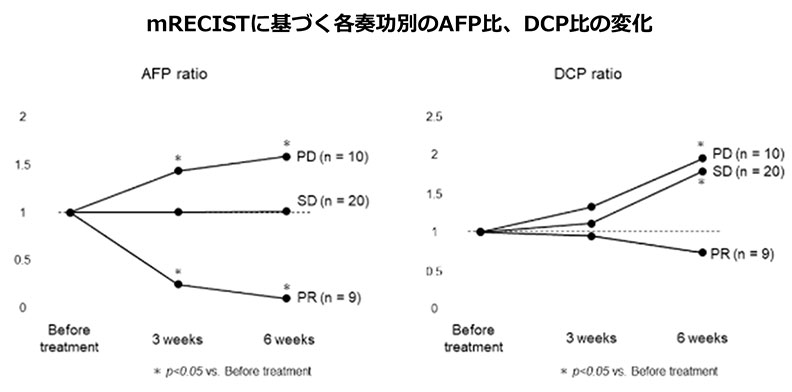
PRを得た症例では治療開始3週、6週後のAFP ratioが有意に減少し、PDと判断された症例では有意に増加した。一方、DCP ratioは、SDまたはPD症例において治療開始6週に有意に増加した。
※AFP比は次の式で算出した.3週後のAFP比=(3週後のAFP値)/(投与前のAFP値),6週後のAFP比=(6週後のAFP値)/(投与前のAFP値).DCP比も同様に算出した。治療前、3週後、6週後の腫瘍マーカーが正常範囲にある場合、比率は1として計算した。
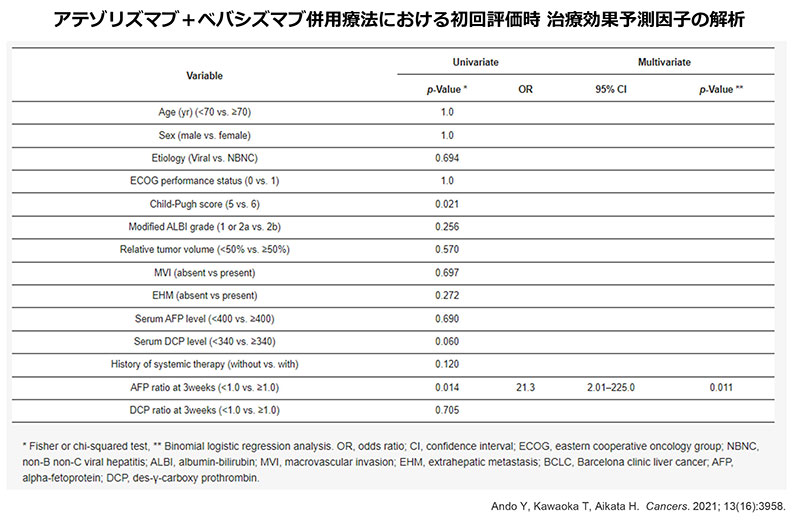
アテゾリズマブ+ベバシズマブ併用療法は、2020年9月に肝細胞癌に対する初の免疫チェックポイント阻害剤を併用した治療法として承認された治療法です。本研究では、アテゾリズマブ+ベバシズマブの早期抗腫瘍効果と安全性について検討しました。
血清AFPの低下は,アテゾリズマブ+ベバシズマブの早期抗腫瘍効果を反映している可能性が示唆されました。また、有害事象や肝予備能の変化についても調査し、本治療法の安全性も確認されました。
引用文献
Kosaka Y, Kawaoka T, Aikata H. A Case of Successful Lenvatinib Re-challenge following Atezolizumab Plus Bevacizumab Combination Therapy Failure for Unresectable Hepatocellular Carcinoma. Intern Med. 2022 Nov 2.
Ando Y, Kawaoka T, Aikata H. Early Tumor Response and Safety of Atezolizumab Plus Bevacizumab for Patients with Unresectable Hepatocellular Carcinoma in Real-World Practice. Cancers. 2021; 13(16):3958.
ヒトゲノム情報を応用した新規の肝疾患診断法・治療法の開発
個々人にとって最適な肝炎・肝癌の治療法選択ができるようなシステムを作るために、「ヒトゲノム」の個人差や、そこに異常が生じた「癌ゲノム」の研究を行っております。これらのゲノム情報を活用することにより、新たな診断法や治療法の開発を目指します。
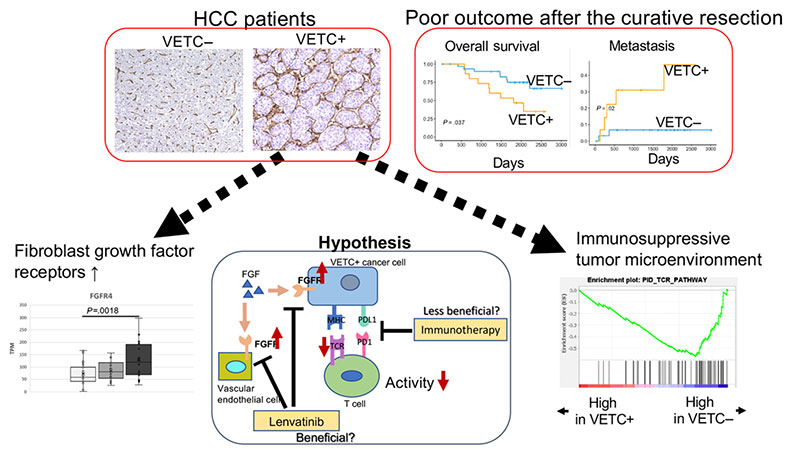
トランスクリプトーム解析および免疫組織学的検討から、類洞様血管構造(vessels that encapsulated tumor clusters; VETC)を有する肝細胞癌では、IFNパスウェイやTCRパスウェイなど、免疫応答に関わる経路の活性が抑制されていることが分かりました。一方で、分子標的薬レンバチニブの治療標的であるFGFR4の発現が亢進していることも分かりました。VETCでは、免疫チェックポイント阻害剤の恩恵を受けにくく、レンバチニブの恩恵を受けやすい可能性が示唆されました。
引用文献
Zhang P, Ono A, Aikata H, et al. The presence of vessels encapsulating tumor clusters is associated with an immunosuppressive tumor microenvironment in hepatocellular carcinoma. Int J Cancer. 2022 Dec 15;151(12):2278-2290.
培養細胞および動物モデルを用いたウイルス性肝炎の病態解明および新規治療法開発
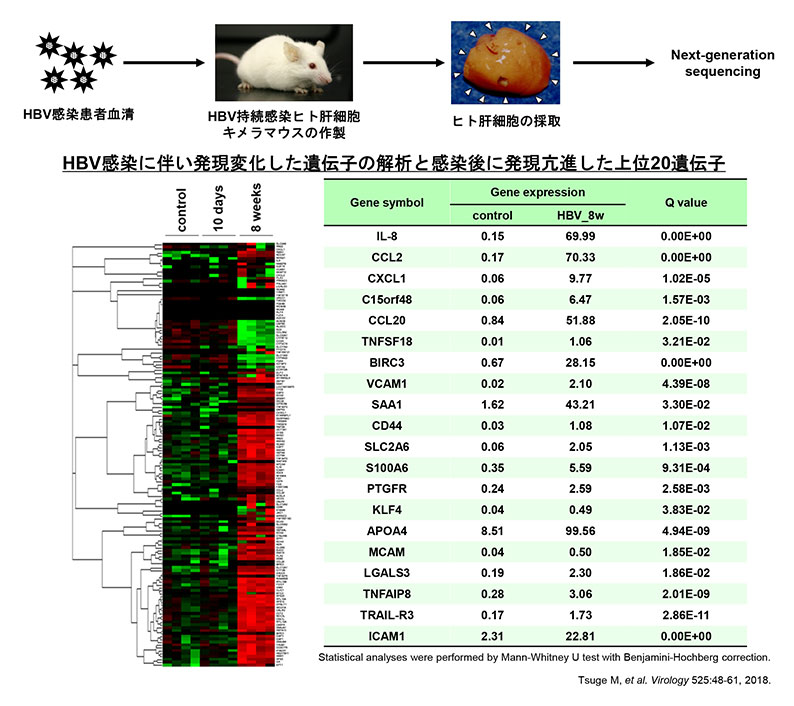
肝炎ウイルスの感染・増殖が可能な培養細胞および動物モデルを用いて、ウイルス性肝炎の病態解明および新規治療法開発を行っております。マウスの肝臓をヒト肝細胞に置換させたヒト肝細胞キメラマウスは、広島大学から発信された肝炎ウイルス感染マウスであり、このマウスモデル用いて、既存の抗ウイルス薬に抵抗性を示す肝炎ウイルスへの有効な治療法開発を目指して研究を行っております。
HBV感染に伴うヒト肝細胞内遺伝子発現変化の解析
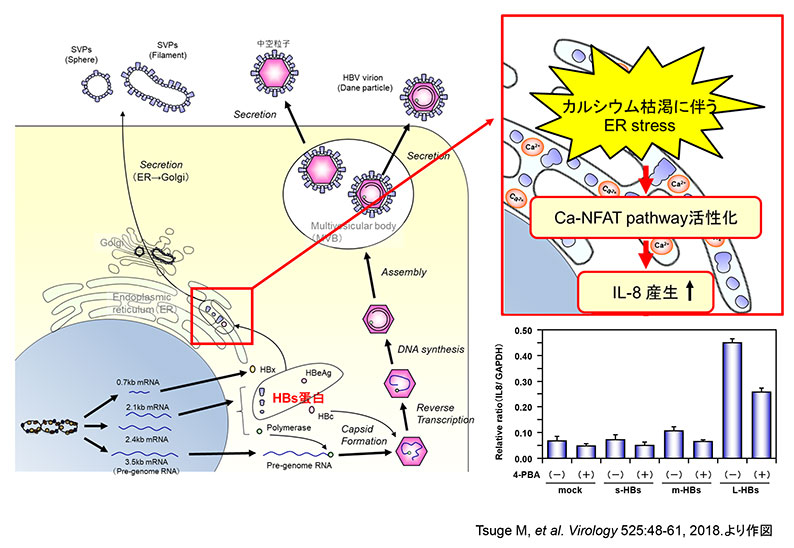
HBV感染後、小胞体内に蓄積したHBs蛋白により小胞体ストレスが惹起され、IL-8産生が亢進する。
HBV感染に伴うIL8発現亢進により、細胞内のインターフェロン反応性が減弱
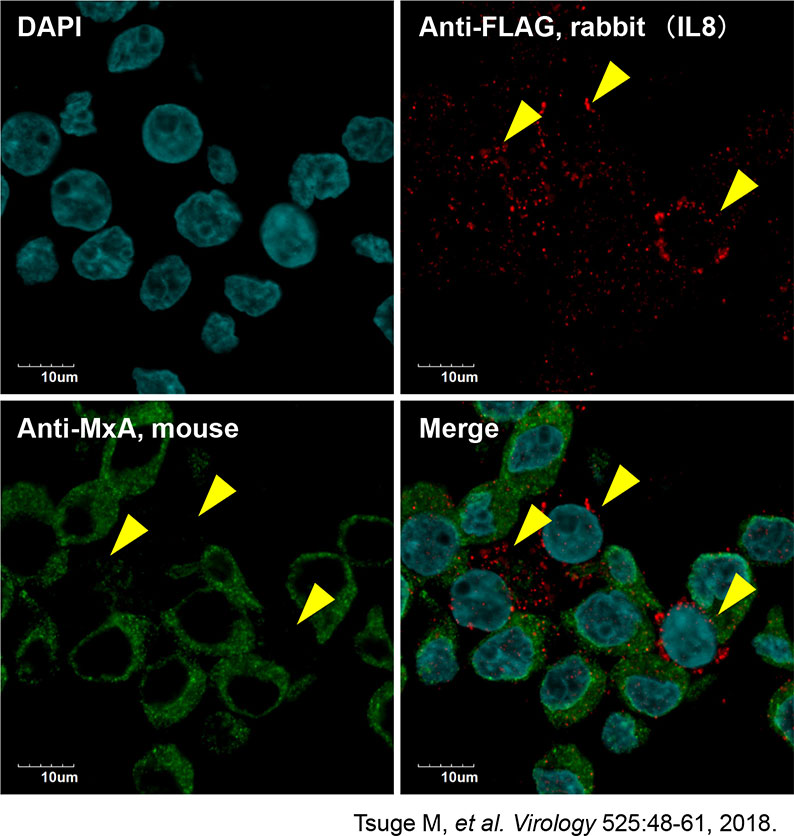
IL8発現亢進細胞では、インターフェロン添加後にインターフェロン誘導遺伝子の一つであるMxA発現誘導が減弱した。→HBVのインターフェロン治療抵抗性に関連。
HBx蛋白がNF-κB pathwayを介してTRAIL-R3の転写を活性化する。
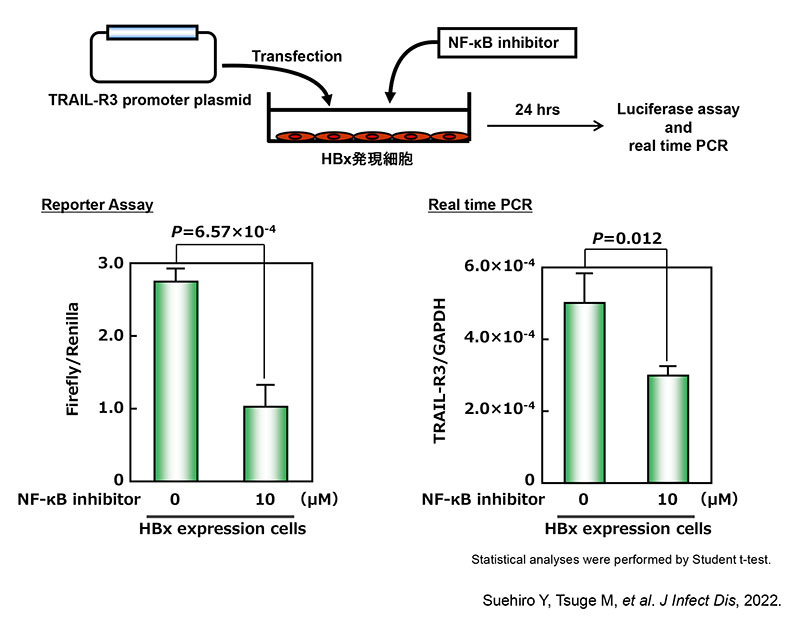
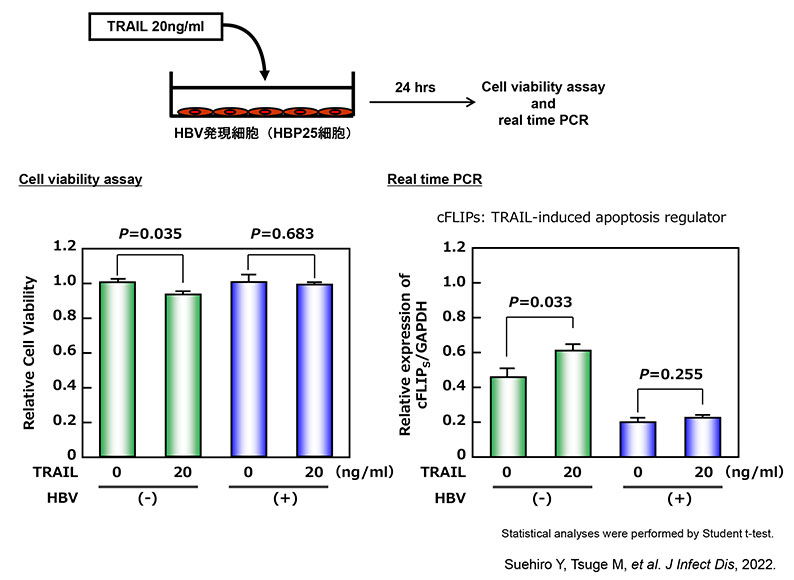
TRAIL-R3発現亢進により、TRAIL誘導apoptosisを抑制する。
引用文献
Tsuge M, et al. Endoplasmic reticulum-mediated induction of interleukin-8 occurs by hepatitis B virus infection and contributes to suppression of interferon responsiveness in human hepatocytes. Virology. 2018 Dec;525:48-61.
Suehiro Y, Tsuge M, et al. HBV upregulates TRAIL-R3 expression in hepatocytes for escaping both cell apoptosis and suppression of their replication by TRAIL. J Infect Dis. 2022 Feb 28
非アルコール性脂肪性肝炎(NAFLD/NASH)の分子機構の解明と新規バイオマーカーの探索
NASHの診断には肝生検による組織学的検査が必須ですが、侵襲的な検査であり、より負担の少ない非侵襲的なバイオマーカーが切望されています。当科では、核内受容体、脂肪酸代謝に関連した基礎研究を進めるとともに、臨床検体を用いたマイクロRNA解析やメタボローム解析などを行い、非侵襲的な診断方法の確立や治療評価の向上を目指しております。


診療・研究に励み、国内外に研究成果を発信するとともに学生・若手医師の指導にも力を入れています。



